题目内容
8.等电子体具有结构相似的特征.下列各对粒子中,空间结构相似的是( )| A. | CS2与NO2 | B. | SO2与O3 | C. | NCl3与BF3 | D. | NH3与SO3 |
分析 原子总数相同、电子总数或价电子总数相同的互为等电子体,等电子体的结构相似、物理性质相似,根据等电子体的概念分析解答.
解答 解:A.CS2与NO2分子中原子个数相等,电子总数和价电子总数都不相同,所以不是等电子体,则其空间构型不相似,故A错误;
B.SO2与O3中原子个数相等,电子总数不相同,但价电子总数相同,所以是等电子体,其空间构型相似,故B正确;
C.PCl3与BF3分子中原子个数相等,电子总数和价电子总数都不相同,所以不是等电子体,则其空间构型不相似,故C错误;
D.NH3与SO3分子中原子个数相等,电子总数和价电子总数都不相同,所以不是等电子体,则其空间构型不相似,故D错误;
故选B.
点评 本题以分子空间构型的判断为载体考查了等电子体,明确等电子体的概念以及电子的计算是解本题关键,题目难度不大.

练习册系列答案
相关题目
18.下列说法不正确的是( )
| A. | 用惰性电极电解饱和食盐水,当电路中转移0.2mol电子时,可得到标准状况下4.48L气体 | |
| B. | 若△H<0,△S<0,则反应A+2B═C+D低温时可能自发进行 | |
| C. | 相同条件下,溶液中等浓度的Fe3+、Cu2+、Zn2+的氧化性依次减弱 | |
| D. | 其它条件不变,增大压强,一定能加快反应速率并提高反应物的平衡转化率 |
16.下列说法正确的是( )
| A. | 电子云伸展方向与电子的能量大小是无关的 | |
| B. | 只含极性键的分子一定是极性分子 | |
| C. | 氢键是一种特殊的化学键,它广泛地存在于自然界中 | |
| D. | H-O键键能为462.8 kJ/mol,即18 g H2O分解成H2和O2时,消耗能量为2×462.8 kJ |
3.某微粒的核外电子排布式为1s22s22p6,下列说法不正确的是( )
| A. | 可以确定该微粒为Ne | |
| B. | 对应元素的单质可能是强还原剂 | |
| C. | 对应元素可能是电负性最大的元素 | |
| D. | 对应元素可能位于元素周期表中第13列 |
13.下列排序错误的是( )
| A. | 熔点由高到低:NaCl>Na-K合金>Na | |
| B. | 晶体的熔点由低到高:CF4<CCl4<CBr4<CI4 | |
| C. | 晶体的硬度由大到小:金刚石>碳化硅>晶体硅 | |
| D. | 晶体的晶格能由大到小:NaF>NaCl>NaBr>NaI |
20.卤族元素的单质和化合物很多,我们可以利用所学《物质结构与性质》的相关知识去认识和理解它们.
(1)卤族元素都位于元素周期表的p区(填“s”、“p”、“d”或“ds”).
(2)在一定浓度的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的.使氢氟酸分子缔合的作用力是氢键.
(3)请根据下表提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是碘(写元素名称).
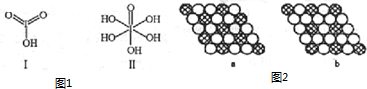
(4)已知碘酸(HIO3)和高碘酸(H5IO6)的结构分别如图1中Ⅰ、Ⅱ所示:
请比较二者酸性的强弱:HIO3>H5IO6(填“>”、“<”或“=”).
(5)如图2所示的二维平面晶体示意图中表示化学式为AX3的是b.(填字母)
(1)卤族元素都位于元素周期表的p区(填“s”、“p”、“d”或“ds”).
(2)在一定浓度的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的.使氢氟酸分子缔合的作用力是氢键.
(3)请根据下表提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是碘(写元素名称).
| 卤族元素 | 氟 | 氯 | 溴 | 碘 |
| 第一电离能(kJ•mol-1) | 1681 | 1251 | 1140 | 1008 |

(4)已知碘酸(HIO3)和高碘酸(H5IO6)的结构分别如图1中Ⅰ、Ⅱ所示:
请比较二者酸性的强弱:HIO3>H5IO6(填“>”、“<”或“=”).
(5)如图2所示的二维平面晶体示意图中表示化学式为AX3的是b.(填字母)
18.化学反应的实质是( )
| A. | 能量的转移 | B. | 旧化学键断裂和新化学键生成 | ||
| C. | 电子转移 | D. | 原子种类与原子数目保持不变 |