题目内容
18.下列说法不正确的是( )| A. | 用惰性电极电解饱和食盐水,当电路中转移0.2mol电子时,可得到标准状况下4.48L气体 | |
| B. | 若△H<0,△S<0,则反应A+2B═C+D低温时可能自发进行 | |
| C. | 相同条件下,溶液中等浓度的Fe3+、Cu2+、Zn2+的氧化性依次减弱 | |
| D. | 其它条件不变,增大压强,一定能加快反应速率并提高反应物的平衡转化率 |
分析 A.用惰性电极电解饱和食盐水,阳极上电极反应式为2Cl--2e-=Cl2↑、阴极上电极反应式为2H++2e-=H2↑,根据转移电子与生成气体之间关系式计算;
B.如果反应中△G=△H-T△S<0时,该反应能自发进行,若△H<0,△S<0时,该反应的△G可能小于0;
C.同一反应中,氧化剂的氧化性大于氧化产物的氧化性;
D.压强大小对于固体和纯液体不适用.
解答 解:A.用惰性电极电解饱和食盐水,阳极上电极反应式为2Cl--2e-=Cl2↑、阴极上电极反应式为2H++2e-=H2↑,根据电极反应式知,如果有0.2mol电子转移,则生成0.1mol氯气、0.1mol氢气,所以可以得到标况下4.48L气体,故A正确;
B.如果反应中△G=△H-T△S<0时,该反应能自发进行,若△H<0,△S<0时,该反应的△G可能小于0,则该反应在低温时可能自发进行,故B正确;
C.相同条件下,铁离子能和Cu反应生成亚铁离子和铜离子,所以氧化性Fe3+>Cu2+;Zn和铜离子反应生成Cu和锌离子,则氧化性Cu2+>Zn2+,所以相同条件下,溶液中等浓度的Fe3+、Cu2+、Zn2+的氧化性依次减弱,故C正确;
D.压强大小对于固体和纯液体不适用,如果反应中只有固体或液体参加反应,则增大压强不影响平衡移动、不影响反应速率,故D错误;
故选D.
点评 本题考查较综合,涉及电解原理、氧化性强弱比较、化学平衡影响因素等知识点,明确化学反应原理、物质或离子性质是解本题关键,注意温度、压强、浓度对化学反应速率影响时的适用范围,易错选项是D.

练习册系列答案
 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案
相关题目
20.下列检验离子的方法及现象描述正确的是( )
| A. | 检验SO42-:加入BaCl2溶液出现白色沉淀,再加足量稀盐酸沉淀不溶解 | |
| B. | 检验Cl-:加入AgNO3溶液出现白色沉淀 | |
| C. | 检验Na+:将干净的铂丝蘸取少量溶液在酒精灯上灼烧,观察火焰呈浅紫色 | |
| D. | 检验NH4+:滴入浓NaOH溶液后,加热,用湿润红色石蕊试纸检验产生气体发现变蓝 |
9.用已知浓度的盐酸滴定未知浓度的NaOH溶液会导致测得的NaOH溶液浓度偏高的是( )
| A. | 滴定前滴定管中有气泡,滴定后消失 | |
| B. | 碱式滴定管量取NaOH溶液时,未进行润洗操作 | |
| C. | 滴定时达到滴定终点时仰视读数 | |
| D. | 锥形瓶取用NaOH待测液前加少量水洗涤 |
13.已知:在25℃时,H2O?H++OH- KW=10-14
CH3COOH?H++CH3COO- Ka=1.8×10-5
KSP[Mg(OH)2]=1.8×10-11、KSP[Zn(OH)2]=1.2×10-17、KSP[Cd(OH)2]=2.5×10-14
又已知:$\sqrt{5}$=2.2
下列说法正确的是( )
CH3COOH?H++CH3COO- Ka=1.8×10-5
KSP[Mg(OH)2]=1.8×10-11、KSP[Zn(OH)2]=1.2×10-17、KSP[Cd(OH)2]=2.5×10-14
又已知:$\sqrt{5}$=2.2
下列说法正确的是( )
| A. | 醋酸钠水解的平衡常数Kh随温度升高而减小 | |
| B. | 0.5mol•L-1醋酸钠溶液pH为m,其水解的程度(已水解的醋酸钠与原有醋酸钠的比值)为a;1mol•L-1醋酸钠溶液pH为n,水解的程度为b,则m<n、a>b | |
| C. | 醋酸钠的水解的平衡常数Kh=KW•Ka | |
| D. | 在某溶液中含Mg2+、Cd2+、Zn2+三种离子的浓度均为0.01mol•L-1,向其中加入固体醋酸钠,使其浓度为0.9mol•L-1,以上三种金属离子中只有Zn2+能生成沉淀 |
3.氰气的化学式为(CN)2,结构式微N≡C-C≡N,性质与卤素相似,下列叙述正确的是( )
| A. | 分子中四个原子共直线,且C为SP杂化 | |
| B. | 分子中N≡C键的键长大于C-C键的键长 | |
| C. | 分子中含有2个σ键和4个π键 | |
| D. | 不和氢氧化钠溶液发生反应 |
10.对如图甲、乙两种化合物的结构或性质描述正确的是( )


| A. | 甲和乙互为同分异构体,均既能发生氧化反应,又能发生酯化反应 | |
| B. | 分子中共平面的碳原子数相同 | |
| C. | 可用红外光谱区分,但不能用核磁共振氢谱区分 | |
| D. | 均能与溴水反应 |
8.等电子体具有结构相似的特征.下列各对粒子中,空间结构相似的是( )
| A. | CS2与NO2 | B. | SO2与O3 | C. | NCl3与BF3 | D. | NH3与SO3 |
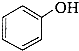
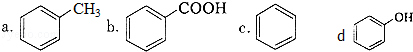
 )是一种重要的有机化工原料.
)是一种重要的有机化工原料.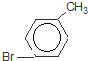 或
或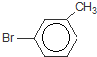 或
或 .
.