题目内容
3.为了提纯下列物质(括号内为杂质),有关除杂试剂和分离方法的选择均正确的是( )| 选项 | 被提纯的物质 | 除杂试剂 | 分离方法 |
| A | 溴苯(溴) | 水 | 分液 |
| B | 乙酸乙酯(乙酸) | NaOH溶液 | 分液 |
| C | 苯(苯酚) | NaOH溶液 | 分液 |
| D | 甲烷(乙烯) | KMnO4酸性溶液 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.互不相溶的液体采用分液方法分离,溴和NaOH溶液反应,但溴苯和NaOH溶液不反应;
B.NaOH溶液和乙酸乙酯、乙酸都反应,但饱和碳酸钠溶液能和乙酸反应,和乙酸乙酯不反应;
C.苯和NaOH溶液不反应且不互溶,苯酚和NaOH溶液反应生成可溶性的苯酚钠;
D.乙烯能被酸性高锰酸钾溶液氧化生成二氧化碳,甲烷和酸性高锰酸钾不反应.
解答 解:A.互不相溶的液体采用分液方法分离,溴和NaOH溶液反应,但溴苯和NaOH溶液不反应,应该用NaOH溶液除去溴,然后采用分液方法分离,故A错误;
B.NaOH溶液和乙酸乙酯、乙酸都反应,但饱和碳酸钠溶液能和乙酸反应,和乙酸乙酯不反应,应该用饱和碳酸钠溶液分离提纯,然后采用分液方法分离,故B错误;
C.苯和NaOH溶液不反应且不互溶,苯酚和NaOH溶液反应生成可溶性的苯酚钠,所以用NaOH溶液除杂然后采用分液方法分离,故C正确;
D.乙烯能被酸性高锰酸钾溶液氧化生成二氧化碳,甲烷和酸性高锰酸钾不反应,乙烯和溴反应生成1,2-二溴乙烷,甲烷和溴不反应,所以应该用溴水除去甲烷中的乙烯,故D错误;
故选C.
点评 本题考查物质分离和提纯,为高频考点,明确物质性质差异性是解本题关键,会根据物质性质差异性正确选取合适的除杂剂及分离方法,易错选项是BD.

练习册系列答案
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案
相关题目
13.下列对有关实验事实的解释或得出的结论合理的是( )
| 选项 | 实验事实 | 解释或结论 |
| A | 被酸雨污染的农田及湖泊可撒石灰石粉末,减轻其危害 | 氧化钙可以与酸反应,生成盐和水 |
| B | 浓硫酸、浓盐酸暴露在空气中浓度降低 | 浓度降低原理相同 |
| C | 常温下,铁在浓硫酸中钝化 | 该过程体现了浓硫酸的强氧化性 |
| D | 向2SO2+O2?2SO3的平衡体系中,充入SO2,平衡正向移动 | V正增大,V逆减小,V正>V逆,所以平衡正向移动 |
| A. | A | B. | B | C. | C | D. | D |
14.下列装置及操作能达到实验目的是( )
| A. | 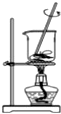 蒸发食盐水得到氯化钠晶体 | B. | 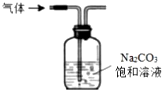 除去CO2中含有少量HCl气体 | ||
| C. | 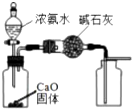 制取并收集干燥纯净的NH3 | D. |  验证SO2的还原性 |
11.高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂.工业上先制得高铁酸钠,然后在低温下,在高铁酸铁的溶液中加入KOH至饱和就可析出高铁酸钾(K2FeO4).
湿法制备:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O,
干法制备:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑
下列有关说法错误的是( )
湿法制备:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O,
干法制备:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑
下列有关说法错误的是( )
| A. | 干法中生成的高铁酸钠既是氧化产物又是还原产物 | |
| B. | 湿法中每生成1mol Na2FeO4 转移3mol电子 | |
| C. | 干法中每生成1 mol Na2FeO4 转移4mol电子 | |
| D. | K2FeO4处理水时,不仅能消毒杀菌,生成的Fe(OH)3胶体还能吸附水中的悬浮杂质 |
18.将下列晶体熔化:NaOH、SiO2、CaO、CCl4,需要克服的微粒间的相互作用①共价键②离子键③分子间作用力,正确的顺序是( )
| A. | ②①②③ | B. | ①②②③ | C. | ②③②① | D. | ①①②③ |
8.下列反应的离子方程式书写正确的是( )
| A. | MgO溶于稀盐酸中:O2-+2H+═H2O | |
| B. | 碳酸钙中滴加稀盐酸:CO32-+2H+═CO2↑+H2O | |
| C. | 实验室用MnO2反应制Cl2:MnO2+2H++2Cl-═Cl2↑+Mn2++H2O | |
| D. | 向氢氧化钠溶液中通入过量二氧化碳:OH-+CO2=HCO3- |
12.将下列选项中的物质加人(或通入)氢硫酸溶液中,可使反应后溶液酸性最终增强的是( )
| A. | 氯气 | B. | 氢氧化钠 | C. | 硫酸钠 | D. | 二氧化硫 |
