题目内容
4.下面a~f是中学化学实验中常见的几种仪器:a.量筒 b.容量瓶 c.托盘天平 d.温度计 e.分液漏斗
(1)标出仪器使用温度的是ab (填写编号).
(2)使用前需要检查是否漏水的是be (填写编号).
(3)称取10.5g固体样品(1g以下使用游码)若样品与砝码错放位置,则实际称取的样品质量为9.5 g.
(4)蒸馏时加入碎瓷片的作用是防止暴沸;分液时应先取下玻璃塞或使塞上的凹槽对准漏斗上的小孔,再放液.
分析 (1)根据温度对仪器的使用是否有影响判断,液体的体积受温度的影响较大,因温度不同,体积不同;
(2)根据仪器使用时能否漏液判断,用于盛装溶液且有塞子或活塞的仪器在使用前需要检查是否漏水;
(3)天平中物体质量=砝码质量+游码质量,如果放错了,左盘的质量=右盘的质量+游码的质量;
(4)通常液体沸点较低,液体混合物加热到沸腾时易暴沸,要加沸石防止液体暴沸,漏斗内外空气相通,漏斗里液体才能够流出.
解答 解:(1)液体的体积受温度的影响较大,温度不同,使用量筒量取的液体、容量瓶中的液体的体积不同,导致产生误差,
故答案为:ab;
(2)c、d不能盛装液体,故错;a使用时不会造成漏液现象,故错;b、e有塞子,所以有漏液的可能,所以要检查是否漏液,
故答案为:be;
(3)称量物体时,游码的数值要加在砝码一边,物体与砝码放反位置时,砝码的质量等于物体的质量加上游码的质量,称量10.5g物体时,砝码的质量是10g,游码的质量数值是0.5g,物体的质量是10g-0.5g=9.5g,
故答案为:9.5;
(4)制蒸馏水时要加热到沸腾,水的沸点低,易暴沸,所以加沸石,沸石多孔结构,引入汽化中心,防止暴沸,分液时应先取下玻璃塞或使塞上的凹槽对准漏斗上的小孔,该步骤操作的目的是为了使漏斗内外空气相通,以保证进行液体顺利流出,再放液,
故答案为:防止暴沸;取下玻璃塞或使塞上的凹槽对准漏斗上的小孔.
点评 本题考查了常见仪器的使用,侧重考查学生对实验基础的掌握情况,题目难度不大,注意基础实验方法的积累.

 优学名师名题系列答案
优学名师名题系列答案无机化合物可根据其组成和性质进行分类:
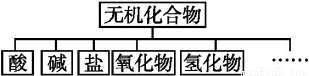
(1)上述所示物质分类方法的名称是 。
(2)以Na、K、H、O、S、N中任两种或三种元素组成合适的物质,分别填在下表中②③⑥后面。(各空填写一个化学式即可)
物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
化学式 | ①HCl ② | ③ ④Ba(OH)2 | ⑤Na2CO3 ⑥ | ⑦CO2 ⑧Na2O | ⑨NH3 ⑩H2O |
(3)写出⑦转化为⑤的化学方程式: 。
(4)写出①与③反应的离子方程式: 。
(5)写出②与⑤反应的离子方程式: 。
(6)书写下列反应的离子方程式
①Fe与CuSO4溶液反应:_________________________;
②CaCO3和稀盐酸溶液:__________________________;
| t℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)上述反应中Q>0 (选填“>”或“<”)
(2)能判断该反应已达到化学平衡状态的依据是cd.
a.容器中压强不变 b.反应热△H不变c.v正(H2)=v逆(CO) d.CO2的质量分数不变
(3)温度为850℃时,可逆反应CO(g)+H2O(g)?CO2(g)+H2(g)在固定容积的密闭容器中进行,容器内物质的浓度变化如表:
850℃时物质的浓度(mol/L)的变化
| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
②反应在4min~5min之间,平衡向逆反应方向移动,可能的原因是b表中5min~6min之间数值发生变化,可能的原因是a
a.增加水蒸气 b.增加氢气浓度 c.使用催化剂.
| A. | NaHCO3 | B. | NaHSO4 | C. | CH3COOH | D. | NH4Cl |
| A. | 含有高氯酸盐的土壤不利于生命存在与高氯酸盐具有较强的还原性有关 | |
| B. | 当元素处于最高价态时一定具有强氧化性 | |
| C. | 可以考虑用加入亚铁盐等还原性物质的方法改善这种土壤 | |
| D. | 高氯酸盐与浓盐酸反应一定只能生成氯气 |
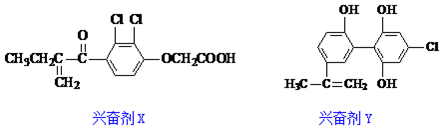
关于它们的说法中正确的是( )
| A. | Y遇到氯化铁溶液时显紫色,但不能使溴的四氯化碳溶液褪色 | |
| B. | X既可以发生氧化反应,又可以发生还原反应 | |
| C. | 1molX与足量氢气反应,最多可消耗6molH2 | |
| D. | 1molY分子中最多有8个碳原子共面 |
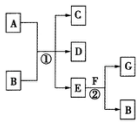 如图,图中,反应①为常温下的反应,A、C、D中均含有氯元素,且A中氯元素的化合价介于C和D中氯元素的化合价之间,E在常温下为无色无味的液体,F是淡黄色固体,G为常见的无色气体.请据图回答下列问题:
如图,图中,反应①为常温下的反应,A、C、D中均含有氯元素,且A中氯元素的化合价介于C和D中氯元素的化合价之间,E在常温下为无色无味的液体,F是淡黄色固体,G为常见的无色气体.请据图回答下列问题: