题目内容
12.在一固定容积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g);△H=Q KJ/mol其化学平衡常数K和温度t的关系如下:| t℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)上述反应中Q>0 (选填“>”或“<”)
(2)能判断该反应已达到化学平衡状态的依据是cd.
a.容器中压强不变 b.反应热△H不变c.v正(H2)=v逆(CO) d.CO2的质量分数不变
(3)温度为850℃时,可逆反应CO(g)+H2O(g)?CO2(g)+H2(g)在固定容积的密闭容器中进行,容器内物质的浓度变化如表:
850℃时物质的浓度(mol/L)的变化
| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
②反应在4min~5min之间,平衡向逆反应方向移动,可能的原因是b表中5min~6min之间数值发生变化,可能的原因是a
a.增加水蒸气 b.增加氢气浓度 c.使用催化剂.
分析 (1)由表中数据可知,温度越高化学平衡常数越大,升高温度平衡向正反应移动,正反应是吸热反应;
(2)根据平衡状态的实质和标志去判断解题;
(3)①依据容器中浓度变化结合化学平衡的三段式列式计算,结合平衡常数不随温度变化,根据转化率公式进行计算;
(4)反应在4min~5min,平衡向逆方向移动,根据平衡移动原理,结合选项判断;
由表中数据可知,5min~6minCO的浓度降低,CO2浓度增大,浓度变化都是0.02mol/L,说明平衡向正反应移动,再结合水的浓度变化进行判断.
解答 解:(1)由表中数据可知,温度越高化学平衡常数越大,升高温度平衡向正反应移动,正反应是吸热反应,故答案为:>;
(2)(a) 容器中压强不变,一直不变,故不选;
(b) 反应热△H不变,一直不变,故不选;
(c) V正(H2)=V逆(CO),正逆反应速度相等,故选;
(d) CO2的质量分数不变,说明各物质的质量不变,正逆反应速度相等,故选;
故选:cd;
(3)①CO(g)+H2O(g)?CO2(g)+H2(g)
起始浓度/mol•L-1 0.2 0.3 0 0
变化浓度/mol•L-1:c3 c3 c3 c3
平衡浓度/mol•L-1:0.2-c3 0.3-c3 c3 c3
由题意知,850℃时,K=1.0,即
K=$\frac{c(C{O}_{2})c({H}_{2})}{c(CO)c({H}_{2}O)}$=$\frac{(0.2-{C}_{3})×(0.3-{C}_{3})}{{C}_{3}×{C}_{3}}$=1.0
解得 c3=0.12mol/L,所以c1=0.08mol/L,H2O(g)的转化率=$\frac{0.12mol/L}{0.3mol/L}$×100%=40%,
故答案为:0.08mol/L、40%;
②反应在4min~5min,平衡向逆方向移动,根据平衡移动原理,结合选项判断;
由表中数据可知,5min~6minCO的浓度降低,CO2浓度增大,浓度变化都是0.02mol/L,说明平衡向正反应移动,再结合水的浓度变化进行判断.②反应在4min~5min,平衡向逆方向移动,增大水蒸气的浓度,平衡向正反应移动,降低温度平衡向正反应移动,使用催化剂平衡不移动,增大氢气的浓度,平衡向逆反应移动,故4min~5min改变条件为增大氢气的浓度,
由表中数据可知,5min~6minCO的浓度降低,CO2浓度增大,浓度变化都是0.02mol/L,说明平衡向正反应移动,而水的浓度增大0.05mol/L,应是增大水蒸气的浓度,故答案为:b,a.
点评 本题主要考查温度对化学平衡、化学平衡常数的影响,化学平衡常数的计算,化学平衡的标志判断,难度不大,考查学生分析和解决问题的能力.

在密闭容器中通入A、B两种气体,在一定条件下反应:2A(g)+B(g)  2C(g) ΔH<0。达到平衡后,改变一个条件(X),下列量(Y)的变化一定符合图中曲线的是( )
2C(g) ΔH<0。达到平衡后,改变一个条件(X),下列量(Y)的变化一定符合图中曲线的是( )
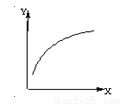
X | Y | |
A | 再加入A | B的转化率 |
B | 再加入C | A的体积分数 |
C | 减小压强 | A的转化率 |
D | 升高温度 | 混合气体平均摩尔质量 |
| A. | R一定是共价化合物 | |
| B. | R一定是离子化合物 | |
| C. | R可能是共价化合物,也可能是离子化合物 | |
| D. | R常温下一定是固态物质 |
| A. | 苯酚钠溶液中通入少量二氧化碳:C6H5O-+CO2+H2O→C6H5OH+HCO3- | |
| B. | 1一氯丙烷中加入氢氧化钠溶液并加热:CH3CH2CH2Cl+NaOH$→_{△}^{水}$CH3CH=CH2↑+NaCl+H2O | |
| C. | 甲醛溶液中加入足量新制碱性Cu(OH)2悬浊液并加热HCHO+2 Cu(OH)2+NaOH$\stackrel{△}{→}$HCOONa+Cu2O↓+3H2O | |
| D. | 向小苏打溶液中加入醋酸:CO32-+2CH3COOH═CO2↑+H2O+2CH3COO- |
 | ① | ② | ③ | ④ | ⑤[ | ⑥ | ⑦ | ⑧ |
| 原子半径/10-10m | 0.66 | 1.36 | 1.23 | 1.10 | 0.99 | 1.54 | 0.70 | 1.18 |
| 最高正化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| 负化合价 | -2 | -3 | -1 | -3 |
| A. | 元素①⑧形成的化合物具有两性 | |
| B. | 元素⑦位于第二周期Ⅴ族 | |
| C. | 元素④⑤形成的化合物是离子化合物 | |
| D. | 元素⑥的最高价氧化物对应水化物碱性最强 |
| A. | 食盐水、牛奶、豆浆 | B. | 碘酒、泥水、血液 | ||
| C. | 白糖水、食盐水、茶叶水 | D. | Ca(OH)2悬浊液、澄清石灰水、石灰浆 |