题目内容
下列叙述正确的是( )
| A、pH=2的醋酸加水稀释100倍后,溶液pH值等于4 |
| B、室温下,物质的量浓度相同的苯甲酸钠溶液比碳酸钠溶液的碱性强 |
| C、相同温度下,pH=2的氯化铁溶液中水的电离度比pH=1的硫酸溶液中水的电离度大 |
| D、pH=3的溶液与pH=11的溶液等体积混合后,溶液一定呈中性 |
考点:弱电解质在水溶液中的电离平衡,pH的简单计算
专题:电离平衡与溶液的pH专题
分析:A、醋酸是弱电解质,在水溶液里存在电离平衡,加水稀释能促进醋酸电离;
B、苯甲酸的酸性比碳酸强,苯甲酸钠溶液的水解程度弱;
C、氯化铁能够水解,可以促进水的电离,硫酸能够抑制水的电离;
D、在室温下,pH=3的溶液与pH=11的溶液中氢离子浓度和氢氧根离子浓度相等,强酸与强碱混合恰好中和.
B、苯甲酸的酸性比碳酸强,苯甲酸钠溶液的水解程度弱;
C、氯化铁能够水解,可以促进水的电离,硫酸能够抑制水的电离;
D、在室温下,pH=3的溶液与pH=11的溶液中氢离子浓度和氢氧根离子浓度相等,强酸与强碱混合恰好中和.
解答:
解:A、如果醋酸是强电解质,则pH=2的醋酸溶液加水稀释100倍,pH=4,实际上醋酸是弱电解质,所以稀释后pH<4,故A错误;
B、苯甲酸的酸性比碳酸强,苯甲酸钠溶液的水解程度弱,物质的量浓度相同的苯甲酸钠溶液比碳酸钠溶液的碱性弱,故B错误;
C、氯化铁能够水解,可以促进水的电离,硫酸能够抑制水的电离,所以,pH=2的氯化铁溶液中水的电离度比pH=1的硫酸溶液中水的电离度大,故C正确;
D、在室温下,pH=3的溶液与pH=11的溶液中氢离子浓度和氢氧根离子浓度相等,强酸与强碱混合恰好中和,弱酸或弱碱时不一定,故D错误;
故选C.
B、苯甲酸的酸性比碳酸强,苯甲酸钠溶液的水解程度弱,物质的量浓度相同的苯甲酸钠溶液比碳酸钠溶液的碱性弱,故B错误;
C、氯化铁能够水解,可以促进水的电离,硫酸能够抑制水的电离,所以,pH=2的氯化铁溶液中水的电离度比pH=1的硫酸溶液中水的电离度大,故C正确;
D、在室温下,pH=3的溶液与pH=11的溶液中氢离子浓度和氢氧根离子浓度相等,强酸与强碱混合恰好中和,弱酸或弱碱时不一定,故D错误;
故选C.
点评:本题考查了弱电解质的电离、盐类水解、水的电离平衡移动、pH相关问题,题目难度中等.

练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目
下列物质的水溶液在蒸发皿中加热蒸干灼烧,能得到原物质的是( )
①NaAlO2 ②FeCl3 ③硫酸铝 ④绿矾 ⑤高锰酸钾 ⑥硝酸银⑦碳酸氢钙 ⑧蛋白质 ⑨Na2SO3 ⑩CaCl2.
①NaAlO2 ②FeCl3 ③硫酸铝 ④绿矾 ⑤高锰酸钾 ⑥硝酸银⑦碳酸氢钙 ⑧蛋白质 ⑨Na2SO3 ⑩CaCl2.
| A、①③⑤⑥⑧⑩ | B、②③④⑤⑨⑩ |
| C、③⑤⑦⑩ | D、①③⑩ |
下列有关实验的操作和现象描述的对应关系正确的是( )
| A、将NaOH溶液逐滴滴入FeSO4溶液中,只观察到白色沉淀 |
| B、将钠放入水中,钠浮在水面上、熔成一个闪亮的小球、四处游动、溶液变红 |
| C、除去表面保护膜的铝在酒精灯上加热到熔化,熔化的铝以小液滴的形式滴落下来 |
| D、在滴有酚酞溶液的 Na2SiO3溶液中,逐滴加入稀盐酸,溶液的红色逐渐变浅,并有白色胶状物生成 |
“化学是实验的科学,只有实验才是检验理论的标准”.下列关于各实验装置图的叙述中,正确的是( )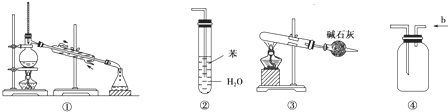

| A、装置①是用于分离互不相溶的液体混合物 |
| B、装置②可用于吸收NH3并防止倒吸 |
| C、以NH4HCO3为原料,装置③可用于实验室制备少量NH3 |
| D、装置④中b进气可收集Cl2、NO等气体 |
固体A的化学式为NH5,它的所有原子的最外层都符合相应稀有气体的最外电子层结构,则下列有关说法不正确的是( )
| A、1 mol NH5中含有5 NA个N-H键(NA表示阿伏加德罗常数) |
| B、NH5中既有共价键又有离子键 |
C、NH5的电子式为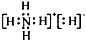 |
| D、它与水反应的离子方程式为NH4++H-+H2O=NH3?H2O+H2↑ |
下列有关环境问题的说法中,不正确的是( )
| A、形成酸雨的主要原因是雨水中溶有CO2 |
| B、氟氯代烷和氮氧化物等会破坏臭氧层 |
| C、CO2、CH4等是造成温室效应的气体 |
| D、白色污染是指废弃塑料制品造成的污染 |
要提取碘水中的碘单质,所选萃取试剂及说法正确的是( )
| A、用酒精后静置则上层颜色加深 |
| B、用汽油二者混溶不分层 |
| C、用CCl4后静置则上层颜色变浅,下层颜色加深 |
| D、用汽油后静置则上层颜色变浅,下层颜色加深 |
 某研究性学习小组的同学在实验室对Cl2使有色物质褪色的机理进行了探究.
某研究性学习小组的同学在实验室对Cl2使有色物质褪色的机理进行了探究.