题目内容
W、X、Y、Z四种短周期元素的原子序数为X>W>Z>Y,W原子的最外层电子数是X原子最外层电子数的一半,Y原子最外层电子数是次外层电子数的2倍,Z原子次外层电子数是最外层电子数的
,这四种元素原子核电荷数总和为37.
(1)Y元素的名称是 .
(2)这四种元素原子半径的大小为 > > > (填元素符号).
(3)W、X元素的最高价氧化物对应的水化物的碱性强弱为 < (用分子式表示).
(4)X元素的单质与氯气反应,形成的化合物的电子式为 .
| 1 |
| 3 |
(1)Y元素的名称是
(2)这四种元素原子半径的大小为
(3)W、X元素的最高价氧化物对应的水化物的碱性强弱为
(4)X元素的单质与氯气反应,形成的化合物的电子式为
考点:原子结构与元素周期律的关系
专题:元素周期律与元素周期表专题
分析:W、X、Y、Z四种短周期元素的原子序数为X>W>Z>Y,Y原子最外层电子数是次外层电子数的2倍,原子只能有2个电子层,最外层电子数为4,故Y为碳元素;Z原子次外层电子数是最外层电子数的
,原子也只能有2个电子层,最外层电子数为6,故Z为氧元素;W原子的最外层电子数是X原子最外层电子数的一半,原子序数均大于O元素,故W、Z处于第三周期,四种元素原子核电荷数总和为37,故W、Z的原子序数之和为37-6-8=23,可以推知W为Na、X为Mg,据此解答.
| 1 |
| 3 |
解答:
解:W、X、Y、Z四种短周期元素的原子序数为X>W>Z>Y,Y原子最外层电子数是次外层电子数的2倍,原子只能有2个电子层,最外层电子数为4,故Y为碳元素;Z原子次外层电子数是最外层电子数的
,原子也只能有2个电子层,最外层电子数为6,故Z为氧元素;W原子的最外层电子数是X原子最外层电子数的一半,原子序数均大于O元素,故W、Z处于第三周期,四种元素原子核电荷数总和为37,故W、Z的原子序数之和为37-6-8=23,可以推知W为Na、X为Mg,
(1)由上述分析可知,Y为碳元素,故答案为:碳;
(2)同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:Na>Mg>C>O,故答案为:Na>Mg>C>O;
(3)金属性Mg<Na,故碱性:Mg(OH)2<NaOH,故答案为:Mg(OH)2;NaOH;
(4)X元素的单质与氯气反应化合物为MgCl2,电子式为 ,故答案为:
,故答案为: .
.
| 1 |
| 3 |
(1)由上述分析可知,Y为碳元素,故答案为:碳;
(2)同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:Na>Mg>C>O,故答案为:Na>Mg>C>O;
(3)金属性Mg<Na,故碱性:Mg(OH)2<NaOH,故答案为:Mg(OH)2;NaOH;
(4)X元素的单质与氯气反应化合物为MgCl2,电子式为
 ,故答案为:
,故答案为: .
.
点评:本题考查结构性质位置关系应用,根据核外电子排布规律推断元素是解题关键,注意对元素周期律的理解掌握,难度不大.

练习册系列答案
相关题目
下列反应中,既属于氧化还原反应,又是吸热反应的是( )
| A、铝片与稀盐酸的反应 |
| B、Ba(OH)2?8H2O与NH4Cl的反应 |
| C、灼热的碳与二氧化碳的反应 |
| D、酒精在空气中的燃烧反应 |
下列方程式书写正确的是( )
| A、HCO3-的电离方程式:HCO3-+H2O═H2CO3+OH- |
| B、NH3?H2O的电离方程式:NH3?H2O?NH4++OH- |
| C、CO32-的水解方程式:CO32-+2H2O?H2CO3+2OH- |
| D、NH4Cl的水解方程式:NH4++H2O═NH3?H2O+H+ |
下列叙述错误的是( )
| A、10ml质量分数为98%的H2SO4,用10ml水稀释后,H2SO4的质量分数大于49% |
| B、配制0.1mol/L的Na2CO3溶液480ml,需用500ml容量瓶 |
| C、在标况下,将22.4L氨气溶于1L水中,得到1mol/L的氨水 |
| D、向2等份不饱和的烧碱溶液中分别加入一定量的Na2O2和Na2O,使溶液均恰好饱和,则加入的Na2O2与Na2O的物质的量之比等于1:1(保持温度不变) |
下列说法不正确的是( )
| A、2,3-二甲基-4-乙基己烷的名称是正确的 |
| B、有机物CH3CO18OH和C2H5OH发生酯化反应的产物为CH3CO18OC2H5和H2O |
C、肌醇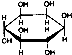 与葡萄糖 与葡萄糖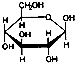 均含有六元环,互为同分异构体 均含有六元环,互为同分异构体 |
D、有机物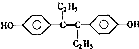 能发生加成反应,氧化反应和还原反应 能发生加成反应,氧化反应和还原反应 |

