题目内容
16.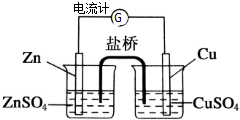 为了避免锌片与Cu2+直接接触发生反应而影响原电池的放电效率,有人设计了如图装置,按要求完成以下填空:
为了避免锌片与Cu2+直接接触发生反应而影响原电池的放电效率,有人设计了如图装置,按要求完成以下填空:(1)此装置工作时,可以观察到的现象是:Zn电极逐渐变细,Cu电极逐渐变粗,电池总反应式为:Zn+Cu2+═Zn2++Cu.
(2)以上电池中,锌和锌盐溶液组成锌半电池,铜和铜盐溶液组成铜半电池,中间通过盐桥连接起来.
(3)电池工作时,硫酸锌溶液中SO42-向左移动,硫酸铜溶液中SO42-向左移动.
(4)此盐桥内为饱和KCl溶液,盐桥是通过离子移动来导电的.在工作时,K+移向硫酸铜溶液.
分析 (1)原电池中负极失电子,正极上溶液中的铜离子得电子,电池总反应为铜离子与锌之间的置换反应;
(2)锌和锌盐溶液组成锌半电池,铜和铜盐溶液组成铜半电池;
(3)原电池中阴离子向负极移动;
(4)盐桥是通过离子移动导电,阴离子向负极移动,阳离子向正极移动.
解答 解:(1)原电池中负极失电子,锌失电子作负极,锌电极逐渐变细,正极上溶液中的铜离子得电子生成铜单质,所以铜电极逐渐变粗,电池总反应为Zn+Cu2+═Zn2++Cu,故答案为:Zn电极逐渐变细,Cu电极逐渐变粗;Zn+Cu2+═Zn2++Cu;
(2)锌和锌盐溶液组成锌半电池,铜和铜盐溶液组成铜半电池,故答案为:锌半电池;铜半电池;
(3)原电池中阴离子向负极移动,溶液中阴离子向负极移动,即硫酸锌溶液中SO42-向左移动,硫酸铜溶液中SO42-向左移动,故答案为:左;左;
(4)盐桥内为饱和KCl溶液,盐桥是通过离子移动导电,阳离子移向正极,即盐桥中K+向硫酸铜溶液移动,故答案为:离子;硫酸铜溶液.
点评 本题考查原电池原理,题目难度中等,注意把握正负极的判断和电子、电流和离子的移动方向.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.宁波气象信息网2011年10月26日13点55分发布环境空气质量实时报告,其中空气污染指数为39,首要污染物为可吸入颗粒物,下列分析不正确的是( )
| A. | 空气质量等级为优 | |
| B. | 二氧化硫的污染指数可能为42 | |
| C. | 目前,我国大部分地区空气中二氧化硫、二氧化氮及可吸入颗粒物等物质的含量偏高 | |
| D. | 对煤、石油等燃料进行脱硫处理、使用氢气等清洁燃料、通过静电沉降器除去悬浮颗粒物都可以治理大气污染,改善空气质量 |
4.有四种短周期元素,它们的结构、性质等信息如下表所述:
请根据表中信息填写:
(1)A原子的核外电子排布式1s22s22p63s1.
(2)B元素在周期表中的位置第3周期第ⅢA族;简单离子半径:B离子小于C离子(填“大于”或“小于”).
(3)D原子的外围电子排布式为3s23p5.
(4)B的最高价氧化物对应的水化物与A的最高价氧化物对应水化物反应的化学方程式为Al(OH)3+NaOH=NaAlO2+2H2O,与C的最高价氧化物对应水化物反应的离子方程式为Al(OH)3+3H+=Al3++3H2O.
| 元素 | 结构、性质等信息 |
| A | 是短周期中(除稀有气体外)原子半径最大的元素,该元素的某种合金是原子反应堆的导热剂 |
| B | B与A同周期,其最高价氧化物的水化物呈两性 |
| C | 元素的气态氢化物极易溶于水,可用作制冷剂 |
| D | 是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂 |
(1)A原子的核外电子排布式1s22s22p63s1.
(2)B元素在周期表中的位置第3周期第ⅢA族;简单离子半径:B离子小于C离子(填“大于”或“小于”).
(3)D原子的外围电子排布式为3s23p5.
(4)B的最高价氧化物对应的水化物与A的最高价氧化物对应水化物反应的化学方程式为Al(OH)3+NaOH=NaAlO2+2H2O,与C的最高价氧化物对应水化物反应的离子方程式为Al(OH)3+3H+=Al3++3H2O.
11.某化合物的化学式为C4H9Cl,它的可能的结构有几种( )
| A. | 2 | B. | 3 | C. | 4 | D. | 5 |
1.设NA为阿伏加德罗常数值,下列说法正确的是( )
| A. | 18 g H2O含有3NA个原子 | |
| B. | 1 mol甲苯含有6NA个C-H键 | |
| C. | 标准状况下,22.4 L氯水含有NA个Cl2分子 | |
| D. | 2.8 g乙烯和丁烯的混合气体中所含原子数为0.2NA |
6.${\;}_{6}^{14}$C常用于考古学年代确定.下列关于${\;}_{6}^{14}$C的说法中正确的是( )
| A. | 中子数是6 | B. | 质量数是14 | C. | 电子数是14 | D. | 中子数是14 |