题目内容
14.由${\;}_{1}^{2}$H和${\;}_{8}^{18}$O组成的11g水中,含有的中子的物质的量为( )| A. | 4.5mol | B. | 5mol | C. | 5.5mol | D. | 6mol |
分析 根据由2H和18O组成的水分子中,相对分子质量为:2×2+18=22,2H含有1个质子、1个中子,18O含有8个质子,10个中子,根据n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$计算.
解答 解:由${\;}_{1}^{2}$H和${\;}_{8}^{18}$O组成水为2H218O,11g 2H218O的物质的量为:$\frac{11g}{22g/mol}$=0.5mol,1个水中含有12个中子,所以0.5mol 2H218O分子中含有中子的物质的量为:12×0.5mol=6mol,
故选D.
点评 本题考查了原子的结构、物质的量的有关计算,题目难度不大,注意从物质的组成、结构等角度思考,试题培养了学生的化学计算能力.

练习册系列答案
 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
4.下列装置,操作正确的是( )
| A. |  用图装置加热氯化铵溶液制取氯化铵晶体 | |
| B. | 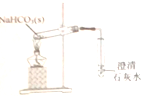 用图装置探究NaHCO3的热稳定 | |
| C. | 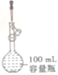 用图装置溶解氯化钠配制100mL1mol•L-1NaCl溶液 | |
| D. |  用图装置比较硫、碳、硅三种元素的非金属性强弱 |
5.Mg-AgCl电池是一种以海水为电解质溶液的水激活电池.下列叙错误的是( )
| A. | 负极反应式为Mg-2e-=Mg2+ | |
| B. | 正极反应式为Ag+e-=Ag | |
| C. | 电池放电时Cl-由正极向负极迁移 | |
| D. | 电池放电时,外电路中,电子由负极向正极移动 |
2.Mg-NaClO电池工作原理如图所示,下列说法不正确的是( )


| A. | Y电极附近溶液中产生白色浑浊 | |
| B. | 电池工作时Na+向正极移动 | |
| C. | 废液的pH大于NaClO溶液的pH | |
| D. | X电极上发生的反应为:ClO-+H2O+2e-═Cl-+2OH- |
9.下列关于乙二醇和丙三醇的说法中,错误的是( )
| A. | 丙三醇、乙二醇的水溶液的凝固点很低,乙二醇可作内燃机的抗冻剂,丙三醇用于配制化妆品 | |
| B. | 丙三醇的沸点比乙二醇的沸点高 | |
| C. | 这两种多元醇均易溶于乙醇,难溶于水 | |
| D. | 乙二醇和丙三醇都能与Na发生反应 |
8.现有三种可溶物质A、B、C,其中A、B是盐,一种是酸式盐,一种是正盐,C是碱,它们溶于水后电离产生的所用离子如表所示:
请根据下列叙述回答问题:
(1)C的化学式为Ba(OH)2.
(2)A溶液与B溶液反应可生成气体X,则X的化学式为CO2,该反应的化学方程式为2NaHSO4+Na2CO3=2Na2SO4+CO2↑+H2O.
(3)A、B溶液与C溶液反应可分别生成白色沉淀D和E,其中D可溶于稀硝酸.
①B的化学式为NaHSO4,鉴别溶液中B的阴离子的方法是先加入盐酸再加入BaCl2溶液,若有白色沉淀生成,则证明溶液中有SO42-.
②D溶于稀硝酸的离子方程式为2H++BaCO3=Ba2++CO2↑+H2O.
| 阳离子 | Na+、H+、Ba2+ |
| 阴离子 | OH-、CO32-、SO42- |
(1)C的化学式为Ba(OH)2.
(2)A溶液与B溶液反应可生成气体X,则X的化学式为CO2,该反应的化学方程式为2NaHSO4+Na2CO3=2Na2SO4+CO2↑+H2O.
(3)A、B溶液与C溶液反应可分别生成白色沉淀D和E,其中D可溶于稀硝酸.
①B的化学式为NaHSO4,鉴别溶液中B的阴离子的方法是先加入盐酸再加入BaCl2溶液,若有白色沉淀生成,则证明溶液中有SO42-.
②D溶于稀硝酸的离子方程式为2H++BaCO3=Ba2++CO2↑+H2O.
6.室温下,在下列给定条件下的个溶液中,一定能大量共存的离子组是( )
| A. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=10-11的溶液:Na+、Ba2+、NO3-、CI- | |
| B. | 0.5mol•L-1Fe(NO3)2溶液:H+、Al3+、SO42-、CI- | |
| C. | 1.0mol•L-1的HNO3溶液:NH4+、[Ag(NH3)2]+、Cl-、SO42- | |
| D. | 使pH试纸显深蓝色的溶液:Na+、Mg2+、NO3-、HSO3- |
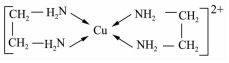
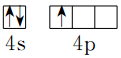 ;
;