题目内容
在下列物质中,①食盐水;②氯气;③氯化钠;④氢氧化钠;⑤酒精;⑥铜
(1)用序号填空,属于电解质的是 ,属于非电解质的是 .
(2)写出下列物质在水中的电离方程式:①HCl: ;②Ba(OH)2: ;③Al2(SO4)3: .
(1)用序号填空,属于电解质的是
(2)写出下列物质在水中的电离方程式:①HCl:
考点:电解质与非电解质,电离方程式的书写
专题:电离平衡与溶液的pH专题
分析:(1)电解质是指:在水溶液中或熔融状态下能够导电的化合物.电解质水溶液中或熔融状态下能够导电,是因电解质自身可以离解成自由移动的离子;而非电解质是指:在熔融状态和水溶液中都不能导电的化合物.也就是说,非电解质在熔融状态和水溶液中自身都不能离解出自由移动的离子;
(2)写物质的电离方程式,首先判断电解质的类型及电离出的阴阳离子,然后根据电解质的类型判断写可逆号还是等号,如果是多元弱酸,要分步电离,如果是多元弱碱,只需一步书写,最后要注意原子守恒、电荷守恒,据此即可解答.
(2)写物质的电离方程式,首先判断电解质的类型及电离出的阴阳离子,然后根据电解质的类型判断写可逆号还是等号,如果是多元弱酸,要分步电离,如果是多元弱碱,只需一步书写,最后要注意原子守恒、电荷守恒,据此即可解答.
解答:
解:(1)①食盐水,是混合物,既不是电解质,也不是非电解质;
②氯气,是单质,既不是电解质,也不是非电解质;
③氯化钠,是化合物,在水溶液中或熔融状态下能够自身电离出自由移动的氯离子和钠离子,能导电,是电解质;
④氢氧化钠,是化合物,在水溶液中或熔融状态下能够自身电离出自由移动的氢氧根离子和钠离子,能导电,是电解质;
⑤酒精,是化合物,但在水溶液中或熔融状态下不能够自身电离出自由移动的离子,只有乙醇分子,是非电解质;
⑥铜,是单质,既不是电解质,也不是非电解质;
故答案为:③④;⑤;
(2)①HCl为强电解质,完全电离,用等于号,故答案为:HCl=H++Cl-;
②Ba(OH)2为强碱,完全一步电离,故答案为:Ba(OH)2=Ba2++2OH-;
③Al2(SO4)3为盐,是强电解质,完全电离,故答案为:Al2(SO4)3=2Al3++3SO42-;
②氯气,是单质,既不是电解质,也不是非电解质;
③氯化钠,是化合物,在水溶液中或熔融状态下能够自身电离出自由移动的氯离子和钠离子,能导电,是电解质;
④氢氧化钠,是化合物,在水溶液中或熔融状态下能够自身电离出自由移动的氢氧根离子和钠离子,能导电,是电解质;
⑤酒精,是化合物,但在水溶液中或熔融状态下不能够自身电离出自由移动的离子,只有乙醇分子,是非电解质;
⑥铜,是单质,既不是电解质,也不是非电解质;
故答案为:③④;⑤;
(2)①HCl为强电解质,完全电离,用等于号,故答案为:HCl=H++Cl-;
②Ba(OH)2为强碱,完全一步电离,故答案为:Ba(OH)2=Ba2++2OH-;
③Al2(SO4)3为盐,是强电解质,完全电离,故答案为:Al2(SO4)3=2Al3++3SO42-;
点评:本题主要考查了电解质和非电解质的辨析,考查了电解质电离方程式的书写,抓住电解质的概念和电解质电离的书写方法是解答的关键.

练习册系列答案
相关题目
亚硝酸(HNO2)的下列性质中,不可以证明它是弱电解质的是( )
| A、100mL l mol/L的亚硝酸溶液恰好与100mL l mol/L的NaOH溶液完全反应 |
| B、0.1mol/L的亚硝酸溶液的PH约为2 |
| C、同浓度的亚硝酸比盐酸导电能力弱 |
| D、10mL同浓度的亚硝酸与盐酸,与等质量锌粉反应,盐酸更快 |
下列在水溶液中能大量共存的离子组是( )
| A、Fe3+、K+、CO32-、OH- |
| B、Ba2+、Na+、SO42-、NO3- |
| C、Na+、Ag+、HCO3-、Cl- |
| D、K+、NH4+、Br-、I- |
用NA表示阿伏加德罗常数的值,下列说法错误的是( )
| A、常温常压下,22.4L氢气中含有的氢分子数为NA |
| B、24gMg变为Mg2+时失去的电子数为2 NA |
| C、32g臭氧分子中含有的氧原子数为2 NA |
| D、1L1mol/LCaCl2溶液中含有氯离子数为2 NA |
设NA为阿伏加德罗常数,下列说法正确的是( )
| A、常温常压下,46 g的NO2和N2O4混合气体含有的原子数为3NA |
| B、200mL 1mol/L Al2(SO4)3溶液中,Al3+和SO42-离子总数为NA |
| C、9gD2O中含有的电子数为5NA |
| D、Na2O2与H2O反应生成1.12L O2(标准状况),反应中转移的电子数为0.2NA |
 图中A~J均代表无机物或其水溶液,其中B、D、G是单质,B是地壳中含量最高的金属元素,G是气体,J是磁性材料.根据图示回答问题:
图中A~J均代表无机物或其水溶液,其中B、D、G是单质,B是地壳中含量最高的金属元素,G是气体,J是磁性材料.根据图示回答问题: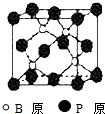 磷化硼(BP)和氮化硼(BN)是受到高度关注的耐磨涂料,它们的结构相似,图为磷化硼晶体结构中最小的重复结构单元.磷化硼可由三溴化硼和三溴化磷在氢气中高温反应合成:BBr3+PBr3+3H2=BP+6HBr.
磷化硼(BP)和氮化硼(BN)是受到高度关注的耐磨涂料,它们的结构相似,图为磷化硼晶体结构中最小的重复结构单元.磷化硼可由三溴化硼和三溴化磷在氢气中高温反应合成:BBr3+PBr3+3H2=BP+6HBr. .
.