题目内容
设NA为阿伏加德罗常数,下列说法中,正确的是( )
| A、18 g水所含分子数目为NA |
| B、17 g NH3所含氢原子数目为NA |
| C、标准状况下,2.24L O2所含的原子数为0.2NA |
| D、2.4 g金属镁所含电子数目为0.2NA |
考点:阿伏加德罗常数
专题:
分析:A、根据水的物质的量计算出含有的分子数;
B、根据氨气的物质的量计算出含有的氢原子数;
C、根据氧气的物质的量计算出含有的氧原子数;
D、1mol金属镁含12mol电子.
B、根据氨气的物质的量计算出含有的氢原子数;
C、根据氧气的物质的量计算出含有的氧原子数;
D、1mol金属镁含12mol电子.
解答:
解:A、18g水的物质的量为1mol,含有分子数目为NA,故A正确;
B、17g氨气的物质的量为1mol,而1mol氨气含3mol氢原子,个数为3NA个,故B错误;
C、标准状况下,2.24L O2的物质的量为1mol,而1mol氧气含2mol氧原子,个数为2NA个,故C正确;
D、2.4g金属镁的物质的量为0.1mol,而1mol金属镁含12mol电子,故0.1mol金属镁含1.2mol电子,故D错误.
故选AC.
B、17g氨气的物质的量为1mol,而1mol氨气含3mol氢原子,个数为3NA个,故B错误;
C、标准状况下,2.24L O2的物质的量为1mol,而1mol氧气含2mol氧原子,个数为2NA个,故C正确;
D、2.4g金属镁的物质的量为0.1mol,而1mol金属镁含12mol电子,故0.1mol金属镁含1.2mol电子,故D错误.
故选AC.
点评:本题考查了阿伏伽德罗常数的有关计算,掌握公式的使用和物质的结构、状态是解题关键,难度不大.

练习册系列答案
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案
相关题目
根据表中信息判断,下列选项正确的是( )
| 序号 | 反应物 | 产物 |
| ① | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4… |
| ② | Cl2、FeBr2 | FeCl3、FeBr3 |
| ③ | MnO4-… | Cl2、Mn2+… |
| A、第①组反应的其余产物只有O2 |
| B、第②组反应中Cl2与FeBr2的物质的量之比为1:2 |
| C、第③组反应中生成1molCl2,转移电子10mol |
| D、氧化性由强到弱顺序为MnO4->Cl2>Fe3+>Br2 |
对于a molH2O和a molCO2的说法正确的是( )
| A、标准状况下体积一定相同 |
| B、分子个数一定相同 |
| C、氧原子个数一定相同 |
| D、质量比是9:22 |
下列说法不正确的是( )
| A、英国科学家道尔顿发现了元素周期律 |
| B、研究物质性质的基本方法有实验法、观察法、分类法、比较法 |
| C、化学的特征是认识分子和制造分子 |
| D、我国科学家合成的结晶牛胰岛素是世界上首次人工合成的具有生物活性的蛋白质 |
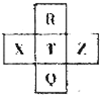 元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中X单质与Na单质的固体研磨发生爆炸.则下列判断不正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中X单质与Na单质的固体研磨发生爆炸.则下列判断不正确的是( )| A、原子半径:R<T<X,非金属性:Z<X<T |
| B、R与Q原子的电子数相差26,属于VIIA族即卤族元素 |
| C、简单阴离子的半径:X>T,气态氢化物稳定性:R<T<Q |
| D、最高价氧化物对应水化物的酸性:T>X、T>Q |
下列反应的离子方程式正确的是( )
| A、向Fe2(SO4)3溶液中滴入KSCN溶液:Fe3++3SCN-?Fe(SCN)3↓ |
| B、向NaHCO3溶液中滴加少量Ca(OH)2溶液:Ca2++OH-+HCO3-=CaCO3↓+H2O |
| C、向NaHSO4溶液中滴加Ba(OH)2溶液至呈中性:2H++SO42-+Ba2++2OH-=2H2O+BaSO4↓ |
| D、用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O=3I2+6OH- |
