题目内容
①甲同学用直流电源、碳棒、铜棒和稀硫酸为原材料,实现了在通常条件下不能发生的反应:Cu+H2SO4(稀)═CuSO4+H2↑,则该同学选用的阳极材料是 .
②乙同学在做铜与稀硫酸的上述反应实验时,看到碳棒和铜棒上都有气泡产生,但铜棒却没有被腐蚀.请你选出最可能的原因 (填字母代号)此时的电解池的总反应为 .
A.铜被稀硫酸钝化 B.碳棒和铜棒与电源正负极接反.
②乙同学在做铜与稀硫酸的上述反应实验时,看到碳棒和铜棒上都有气泡产生,但铜棒却没有被腐蚀.请你选出最可能的原因
A.铜被稀硫酸钝化 B.碳棒和铜棒与电源正负极接反.
考点:原电池和电解池的工作原理
专题:电化学专题
分析:①该反应不能自发进行,要实现该反应,应该设计成电解池,失电子发生氧化反应的金属作阳极材料;
②如果将Cu、C电极接反,则阳极上氢氧根离子放电、阴极上氢离子放电.
②如果将Cu、C电极接反,则阳极上氢氧根离子放电、阴极上氢离子放电.
解答:
解:①该反应不能自发进行,要实现该反应,应该设计成电解池,失电子发生氧化反应的金属作阳极材料,该方程式中Cu失电子发生氧化反应,所以阳极材料是Cu,
故答案为:Cu棒;
②如果将Cu、C电极接反,则阳极上氢氧根离子放电生成氧气、阴极上氢离子放电生成氢气,所以两个电极上都有气体生成,实际上是电解水,电池反应式为2H2O
2H2↑+O2↑,故答案为:B;2H2O
2H2↑+O2↑.
故答案为:Cu棒;
②如果将Cu、C电极接反,则阳极上氢氧根离子放电生成氧气、阴极上氢离子放电生成氢气,所以两个电极上都有气体生成,实际上是电解水,电池反应式为2H2O
| ||
| ||
点评:本题考查电解原理,不能自发进行的氧化还原反应可以设计成电解池,如果阳极材料是活泼金属,阳极上金属失电子而不是电解质溶液中阴离子失电子,为易错点.

练习册系列答案
相关题目
25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )
| A、0.1mol/LCH3COONa与0.1mol/LHCl溶液等体积混合:c(Na+)=c(Cl-)>c(CH3COO-)>c(H+)>c(OH-) | ||
| B、0.1mol/LH2SO4与0.1mol/L氨水等体积混合:c(H+)>c(NH4+)>c(SO42-)>c(OH-) | ||
C、0.1mol/LNa2CO3与0.1mol/L NaHCO3溶液等体积混合:
| ||
| D、0.1mol/LNa2C2O4与0.1mol/LHCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)=c(Na+)+c(H+) |
将BaO2放入密闭真空容器中,反应BaO2(s)?BaO(s)+
O2(g)达到平衡,保持温度不变,缩小容器容积,体系重新达到平衡,下列说法正确的是( )
| 1 |
| 2 |
| A、氧气压强不变 | ||||
| B、BaO质量增加 | ||||
| C、BaO2质量不变 | ||||
D、平衡常数K=
|
下列分子或离子在指定条件的分散系中能大量共存的是( )
| A、Ca(NO3)2溶液中:Fe2+、H+、Cl-、SO42- |
| B、使pH试纸变蓝的溶液中:K+、NH4+、S-、SO32- |
| C、水电离出的c(H+)=10-12 mol?L-1的溶液中:Na+、Ba2+、HCO3-、CH3COO- |
| D、透明的强酸性溶液中:Al3+、Fe3+、Cl-、SO42 |
在强酸性溶液中下列离子能大量共存的是( )
| A、Ca2+、Na+、OH-、CO32- |
| B、Ag+、SO42-、HCO3-、Cl- |
| C、Cu2+、Na+、SO42-、NO3- |
| D、NH4+、S2-、Mg2+、Cu2+ |
下列有关叙述中正确的是( )
| A、因为s轨道的形状是球形的,所以s电子做的是圆周运动 |
| B、3px、3py、3pz的差异之处在于三者中电子(基态)的能量不同 |
| C、原子轨道和电子云都是用来形象地描述电子运动状态的 |
| D、H2、F2、HCl和H2O中的σ键都是sp σ键 |
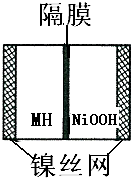 如图是在航天用高压氢镍电池基础上发展起来的一种金属氢化物镍电池(MH-Ni电池).下列有关说法不正确的是( )
如图是在航天用高压氢镍电池基础上发展起来的一种金属氢化物镍电池(MH-Ni电池).下列有关说法不正确的是( )| A、放电时正极反应为:NiOOH+H2O+e-═Ni(OH)2+OH- |
| B、电池的电解液可为稀H2SO4溶液 |
| C、充电时负极反应为:MH+OH--e-═H2O+M |
| D、MH是一类储氢材料,其所含氢密度越大,电池的能量密度越高 |
1g氢气燃烧生成液态水时放出142.9kJ热量,表示该反应的热化学方程式正确的是( )
| A、2H2(g)+O2(g)═2H2O(l)△H=-142.9 kJ?mol-1 |
| B、2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ?mol-1 |
| C、2H2+O2═2H2O△H=-571.6 kJ?mol-1 |
| D、2H2(g)+O2(g)═2H2O(l)△H=+571.6 kJ?mol-1 |