题目内容
18.下列说法中正确的是( )| A. | 物质的量就是物质的质量 | |
| B. | 摩尔是国际单位制中七个基本物理量之一 | |
| C. | 物质的量是量度物质所含微粒多少的一个物理量 | |
| D. | 1mol任何物质都含有6.02×1023个微粒 |
分析 A、物质的量≠物质的质量;
B、摩尔是物质的量的单位;
C、物质的量是用于衡量微粒的集合体的一个物理量;
D、将NA个微粒看做一个整体,为1mol.
解答 解:A、物质的量≠物质的质量,是一个专门的物理量,故A错误;
B、摩尔是物质的量的单位,而物质的量是七个基本物理量之一,故摩尔是七个基本物理量的单位之一,故B错误;
C、物质的量是用于衡量微粒的集合体的一个物理量,只能用于衡量微观粒子,不能用于衡量宏观物质,故C正确;
D、将NA个微粒看做一个整体,为1mol,故1mol任何物质均含有NA个微粒,故D正确.
故选CD.
点评 本题考查了物质的量的单位和摩尔的含义,难度不大,应注意的是1mol任何物质均含有NA个微粒,而不是NA个原子或离子.

练习册系列答案
 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目
8.人体中缺乏某种微量元素时,会引起甲状腺肿大,该元素是( )
| A. | 碘 | B. | 铁 | C. | 铜 | D. | 硒 |
6.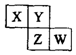 短周期元素X、Y、Z、W在元素周期表中的位置关系如图所示.若Y原子最外层电子数是内层电子数的3倍,下列说法正确的是( )
短周期元素X、Y、Z、W在元素周期表中的位置关系如图所示.若Y原子最外层电子数是内层电子数的3倍,下列说法正确的是( )
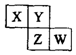 短周期元素X、Y、Z、W在元素周期表中的位置关系如图所示.若Y原子最外层电子数是内层电子数的3倍,下列说法正确的是( )
短周期元素X、Y、Z、W在元素周期表中的位置关系如图所示.若Y原子最外层电子数是内层电子数的3倍,下列说法正确的是( )| A. | 原子半径:W>Z>Y>X | |
| B. | 最高正化合价:Z>W>X | |
| C. | 氢化物溶液的pH:W>X | |
| D. | 四种元素的单质中,Z单质的熔沸点最高 |
13.下列物质中,只有共价键的是( )
| A. | Ca(NO3)2 | B. | KOH | C. | H2O | D. | NH4F |
10.下列叙述正确的是( )
| A. | 在氧化还原反应中,肯定有一种元素被氧化,另一种元素被还原 | |
| B. | 阳离子只具有氧化性,阴离子只具有还原性 | |
| C. | 置换反应一定是氧化还原反应 | |
| D. | 物质在反应中失去电子数越多,其还原性越强 |
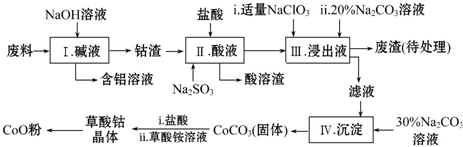
14.钴(Co)及其化合物在工业上有广泛应用,为从某工业废料中回收钴,设计了如下流程(废料中含有Al、Li、Co2O3和Fe2O3等物质).
已知:部分金属离子形成氢氧化物沉淀的pH见下表:
请回答:
(1)步骤Ⅰ中得到含铝溶液的溶质是NaAlO2.
(2)写出步骤Ⅱ中Co2O3与Na2SO3反应的离子方程式是Co2O3+SO32-+4H+=Co2++SO42-+2H2O.
(3)步骤Ⅲ中若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,则该有毒气体是Cl2,其中,Na2CO3溶液的作用是调节溶液PH使铁离子沉淀完全转化为Fe(OH)3.
(4)在空气中加热草酸钴晶体(CoC2O4•2H2O)样品需要用到的主要仪器是坩埚,5.49g该晶体受热过程中不同温度范围内分别得到一种固体物质,其质量如下表:
经测定,210~290℃过程中产生的气体只有CO2,此过程发生反应的化学方程式是3CoC2O4+2O2 $\frac{\underline{\;210℃-290℃\;}}{\;}$Co3O4+6CO2.[M(CoC2O4•2H2O)=183g•mol-1]
(5)从反应后的混合物中得到草酸钴晶体,需对晶体进行洗涤,洗涤的方法是在漏斗中加水没过沉淀,让水自行留下,重复2~3次.

已知:部分金属离子形成氢氧化物沉淀的pH见下表:
| Fe3+ | Co2+ | Co3+ | Al3+ | |
| pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
| pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 5.2 |
(1)步骤Ⅰ中得到含铝溶液的溶质是NaAlO2.
(2)写出步骤Ⅱ中Co2O3与Na2SO3反应的离子方程式是Co2O3+SO32-+4H+=Co2++SO42-+2H2O.
(3)步骤Ⅲ中若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,则该有毒气体是Cl2,其中,Na2CO3溶液的作用是调节溶液PH使铁离子沉淀完全转化为Fe(OH)3.
(4)在空气中加热草酸钴晶体(CoC2O4•2H2O)样品需要用到的主要仪器是坩埚,5.49g该晶体受热过程中不同温度范围内分别得到一种固体物质,其质量如下表:
| 温度范围/℃ | 固体质量/g |
| 150~210 | 4.41 |
| 290~320 | 2.41 |
| 890~920 | 2.25 |
(5)从反应后的混合物中得到草酸钴晶体,需对晶体进行洗涤,洗涤的方法是在漏斗中加水没过沉淀,让水自行留下,重复2~3次.