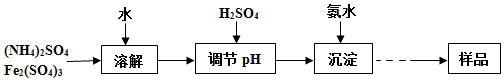
题目内容
8.下列条件下,两瓶气体所含原子数一定相等的是( )| A. | 同质量、不同密度的NO和CO | B. | 同温度、同体积的H2和O2 | ||
| C. | 同体积、同密度的C2H4和C3H6 | D. | 同压强、同体积的N2O和CO2 |
分析 两瓶气体所含的原子数一定相等,则原子的物质的量相同,结合n=$\frac{m}{M}$及物质的构成解答.
解答 解:A.同质量、不同密度的NO和CO,物质的量不相等,则O原子的物质的量不相同,则数目不相同,故A错误;
B.同温度、同体积的H2和O2,压强未知,则物质的量的关系不确定,原子数不一定相等,故B错误;
C.同体积同密度的C2H4和C3H6,两种气体的质量相同,由N=nNA=$\frac{m}{M}$NA结合分子构成知,所含原子数相同,故C正确;
D.气体体积受温度压强的影响,因为温度未知,所以同压同体积的N2O和CO2,两种气体的物质的量不一定相等,所含分子数不一定相等,导致所含原子数不一定相等,故D错误;
故选:C.
点评 本题考查原子数的有关计算,以及阿伏加德罗定律及推论,题目难度不大,注意把握物质的量、质量、体积之间的计算公式的运用.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
19.“毒胶囊”泛指利用由工业皮革废料为原料生产的含重金属铬(Cr)超标的胶囊,其中含有可能引起人体肾伤害的+6 价的铬.下列铬的化合物中铬呈+6 价的是( )
| A. | Cr2(SO4)3 | B. | Cr2O3 | C. | K2Cr2O7 | D. | Cr(OH)3 |
3.将一块银白色的金属钠放在空气中会发生一系列的变化:表面迅速变暗→“出汗”→变成白色固体(粉末),下列有关叙述中不正确的是( )
| A. | 表面迅速变暗是因为钠与空气中的氧气反应生成了氧化钠 | |
| B. | “出汗”是因为生成的氢氧化钠吸收空气中的水蒸气在表面形成了溶液 | |
| C. | “出汗”→变成白色固体(粉末)过程中只发生物理变化 | |
| D. | 最后变成碳酸钠粉末 |
13.学习化学要准确掌握化学基本概念和研究方法.按要求回答下列问题:
(1)下列是某同学对有关物质进行分类的列表:
找出上述三组分类中的错误,错误物质的化学式为Na2CO3.
找出上述三组分类中的错误,错误物质的化学式为Al2O3.
(2)下列2个反应,按要求填写相关量.
①2Na2O2+2H2O=4NaOH+O2反应中,每消耗lmol Na2O2生成16g O2;
②除去NaCl溶液中少量的Na2SO4杂质,要判断所加BaCl2溶液是否过量,可向滤液中加入X溶液,X可以是D( )填代号)
A. NaOH B.AgNO3 C.HCl D.Na2SO4.
(1)下列是某同学对有关物质进行分类的列表:
| 碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 | |
| 第一组 | Na2CO3 | H2SO4 | NaHCO3 | CaO | CO2 |
| 第二组 | NaOH | HCl | NaCl | Na2O | SO2 |
| 第三组 | NaOH | CH3COOH | CaF2 | Al2O3 | SO2 |
找出上述三组分类中的错误,错误物质的化学式为Al2O3.
(2)下列2个反应,按要求填写相关量.
①2Na2O2+2H2O=4NaOH+O2反应中,每消耗lmol Na2O2生成16g O2;
②除去NaCl溶液中少量的Na2SO4杂质,要判断所加BaCl2溶液是否过量,可向滤液中加入X溶液,X可以是D( )填代号)
A. NaOH B.AgNO3 C.HCl D.Na2SO4.
20.下列说法中正确的是( )
| A. | 任何一个水分子,其本身都是固体 | |
| B. | 逐渐加热升温,碳酸氢铵也可体现出三态变化 | |
| C. | 面包是固体,但在受压时体积缩小,故可以说固体易被压缩 | |
| D. | 在水蒸气、液态水和冰中,水分子都在不停地运动 |
17.在盛放浓硫酸的试剂瓶标签上应该印有下列警示标记中的( )
| A. |  爆炸品 | B. |  易燃液体 | C. |  剧毒品 | D. |  腐蚀品 |
18.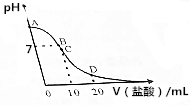 25℃,在20mL0.1mol•L-1氨水溶液中逐滴加入0.2mol•L-1HCl溶液,溶液的pH与所加盐酸的体积关系如图所示,已知0.1mol•L-1氨水的电离度为1.32%.下列说法不正确的是( )
25℃,在20mL0.1mol•L-1氨水溶液中逐滴加入0.2mol•L-1HCl溶液,溶液的pH与所加盐酸的体积关系如图所示,已知0.1mol•L-1氨水的电离度为1.32%.下列说法不正确的是( )
 25℃,在20mL0.1mol•L-1氨水溶液中逐滴加入0.2mol•L-1HCl溶液,溶液的pH与所加盐酸的体积关系如图所示,已知0.1mol•L-1氨水的电离度为1.32%.下列说法不正确的是( )
25℃,在20mL0.1mol•L-1氨水溶液中逐滴加入0.2mol•L-1HCl溶液,溶液的pH与所加盐酸的体积关系如图所示,已知0.1mol•L-1氨水的电离度为1.32%.下列说法不正确的是( )| A. | 在A点处的溶液中pH<12 | B. | 在B点:c(NH4+)=c(Cl-)>c(OH-)>c(H+) | ||
| C. | 在C点:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | D. | 在D点:c(NH4+)+c(NH3•H2O)=2c(Cl-) |