题目内容
18.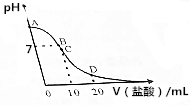 25℃,在20mL0.1mol•L-1氨水溶液中逐滴加入0.2mol•L-1HCl溶液,溶液的pH与所加盐酸的体积关系如图所示,已知0.1mol•L-1氨水的电离度为1.32%.下列说法不正确的是( )
25℃,在20mL0.1mol•L-1氨水溶液中逐滴加入0.2mol•L-1HCl溶液,溶液的pH与所加盐酸的体积关系如图所示,已知0.1mol•L-1氨水的电离度为1.32%.下列说法不正确的是( )| A. | 在A点处的溶液中pH<12 | B. | 在B点:c(NH4+)=c(Cl-)>c(OH-)>c(H+) | ||
| C. | 在C点:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | D. | 在D点:c(NH4+)+c(NH3•H2O)=2c(Cl-) |
分析 A.A点处的溶液0.1mol•L-1氨水溶液,一水合氨存在电离平衡,该氨水电离度为1.32%,则该溶液中c(OH-)=0.10mol/L×1.32%=1.32×10-3 mol/L,c(H+)=$\frac{Kw}{c(O{H}^{-})}$;
B.M处溶液呈中性,则存在c(H+)=c(OH-),根据电荷守恒得c(NH4+)=c(Cl-),该点溶液中溶质为氯化铵和一水合氨,铵根离子水解而促进水电离、一水合氨抑制水电离,铵根离子水解和一水合氨电离相互抑制;
C.C点是加入10ml0.2mol•L-1HCl和20mL0.1mol•L-1氨水溶液反应得到氯化铵的溶液,铵根离子水解溶液显酸性;
D.在D点是加入20ml0.2mol•L-1HCl和20mL0.1mol•L-1氨水溶液反应得到氯化铵和HCl的混合溶液,溶液显酸性.
解答 解;A.点为氨水溶液,加入氨水浓度为0.10mol•L-1,该氨水电离度为1.32%,则该溶液中c(OH-)=0.10mol/L×1.32%=1.32×10-3 mol/L,c(H+)=$\frac{1{0}^{-14}}{1.32×1{0}^{-3}}$mol/L=7.6×10-12mol/L,所以该点溶液pH<12,故A正确;
B.M处溶液呈中性,则存在c(H+)=c(OH-),根据电荷守恒得c(NH4+)=c(Cl-),该点溶液中溶质为氯化铵和一水合氨,铵根离子水解而促进水电离、一水合氨抑制水电离,铵根离子水解和一水合氨电离相互抑制,水的电离程度很小,该点溶液中离子浓度大小顺序是c(NH4+)=c(Cl-)>c(H+)=c(OH-),故B错误;
C.C点是加入10ml0.2mol•L-1HCl和20mL0.1mol•L-1氨水溶液反应得到氯化铵和HCl的混合溶液,铵根离子水解溶液显酸性,离子浓度大小为:c(Cl-)>c(NH4+)>c(H+)>c(OH-),故C正确;
D.在D点是加入20ml0.2mol•L-1HCl中n(Cl-)=0.02L×0.2mol•L-1=0.004mol,氨水溶液中一水合氨物质的量n(NH3•H2O)=0.020L×0.1mol•L-1=0.002mol,反应得到等浓度的氯化铵和HCl的混合溶液,c(NH4+)+c(NH3•H2O)=$\frac{1}{2}$c(Cl-),故D错误;
故选BD.
点评 本题考查酸碱混合溶液定性判断,为高频考点,识图及分析判断能力,明确弱电解质的电离、电解质溶液中电荷守恒和物料守恒等知识点是解本题关键,题目难度中等.

| A. | 同质量、不同密度的NO和CO | B. | 同温度、同体积的H2和O2 | ||
| C. | 同体积、同密度的C2H4和C3H6 | D. | 同压强、同体积的N2O和CO2 |
| A. | 单质硅可用于制造光纤和太阳能电池 | |
| B. | 火柴头的主要成分是氯酸钾和硫单质,分别属于电解质和非电解质 | |
| C. | 在常温下可用铝制容器贮藏运输浓硫酸 | |
| D. | BaSO4难溶于酸,所以可以用稀盐酸和Ba(NO3)2溶液检验SO42- |
| A. | Al(OH)3分解 | B. | CO2+OH- | C. | Al+OH-+H2O | D. | Al2O3+OH- |
| 容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | ||
| H2 | SO2 | H2 | SO2 | ||
| 容器Ⅰ | 300 | 0.3 | 0.1 | / | 0.02 |
| 容器Ⅱ | 300 | 0.6 | 0.2 | / | / |
| 容器Ⅲ | 240 | 0.3 | 0.1 | / | 0.01 |
| A. | 该反应的正反应吸热 | |
| B. | 到达平衡时,容器Ⅰ中SO2的转化率比容器Ⅱ的大 | |
| C. | 240℃时,该反应的平衡常数为1.08×104 | |
| D. | 到达平衡时,容器Ⅲ中的正反应速率比容器Ⅰ中的大 |
| A. | 冰融化为水的过程△H>0,△S<0 | |
| B. | 在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的方向 | |
| C. | 在常温下,放热反应一般能自发进行,吸热反应都不能自发进行 | |
| D. | NH4HCO3(s)?NH3(g)+H2O(g)+CO2(g)△H=+185.57kJ/mol,能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向 |