题目内容
目前,回收溴单质的方法主要有水蒸气蒸馏法和萃取法等.某兴趣小组通过查阅相关资料拟采用如下方案从富马酸废液(含溴0.27%)中回收易挥发的Br2:

(1)操作X所需要的主要玻璃仪器为 ;反萃取时加入20%的NaOH溶液,其离子方程式为 .
(2)反萃取所得水相酸化时,需缓慢加入浓硫酸,并采用冰水浴冷却的原因是 .
(3)溴的传统生产流程为先采用氯气氧化,再用空气水蒸气将Br2吹出.与传统工艺相比,萃取法的优点是 .
(4)我国废水三级排放标准规定:废水中苯酚的含量不得超过1.00mg/L.实验室可用一定浓度的溴水测定某废水中苯酚的含量,其原理如下:
①请完成相应的实验步骤:
步骤1:准确量取25.00mL待测废水于250mL锥形瓶中.
步骤2:将4.5mL 0.02mol/L溴水迅速加入到锥形瓶中,塞紧瓶塞,振荡.
步骤3:打开瓶塞,向锥形瓶中加入过量的0.1mol/L KI溶液,振荡.
步骤4: ,再用0.01mol/L Na2S2O3标准溶液滴定至终点,消耗 Na2S2O3溶液15mL.(反应原理:I2+2Na2S2O3=2NaI+Na2S4O6)
步骤5:将实验步骤1~4重复2次.
②该废水中苯酚的含量为 mg/L.
③步骤3若持续时间较长,则测得的废水中苯酚的含量 (填“偏高”、“偏低”或“无影响”).

(1)操作X所需要的主要玻璃仪器为
(2)反萃取所得水相酸化时,需缓慢加入浓硫酸,并采用冰水浴冷却的原因是
(3)溴的传统生产流程为先采用氯气氧化,再用空气水蒸气将Br2吹出.与传统工艺相比,萃取法的优点是
(4)我国废水三级排放标准规定:废水中苯酚的含量不得超过1.00mg/L.实验室可用一定浓度的溴水测定某废水中苯酚的含量,其原理如下:

①请完成相应的实验步骤:
步骤1:准确量取25.00mL待测废水于250mL锥形瓶中.
步骤2:将4.5mL 0.02mol/L溴水迅速加入到锥形瓶中,塞紧瓶塞,振荡.
步骤3:打开瓶塞,向锥形瓶中加入过量的0.1mol/L KI溶液,振荡.
步骤4:
步骤5:将实验步骤1~4重复2次.
②该废水中苯酚的含量为
③步骤3若持续时间较长,则测得的废水中苯酚的含量
考点:"三废"处理与环境保护
专题:实验设计题
分析:富马酸废液中含有Br-,电解生成溴单质,加入四氯化碳萃取后分液,再加入氢氧化钠反萃取得到含修炼者和次溴酸根离子的溶液,加入硫酸酸化发生氧化还原反应生成溴单质;
(1)操作X为萃取分液,需要烧杯、分液漏斗等仪器;反萃取时加入20%的NaOH溶液反应生成溴化钠、次溴酸钠和水;
(2)溴单质易挥发,浓硫酸溶解放热分析;
(3)无有毒气体氯气参加反应,生产过程环保;
(4)①硫代硫酸钠溶液滴定碘单质,加入淀粉溶液做指示剂;
②依据化学方程式定量关系计算;
③步骤3持续的时间长导致的是KI被氧化;
(1)操作X为萃取分液,需要烧杯、分液漏斗等仪器;反萃取时加入20%的NaOH溶液反应生成溴化钠、次溴酸钠和水;
(2)溴单质易挥发,浓硫酸溶解放热分析;
(3)无有毒气体氯气参加反应,生产过程环保;
(4)①硫代硫酸钠溶液滴定碘单质,加入淀粉溶液做指示剂;
②依据化学方程式定量关系计算;
③步骤3持续的时间长导致的是KI被氧化;
解答:
解:富马酸废液中含有Br-,电解生成溴单质,加入四氯化碳萃取后分液,再加入氢氧化钠反萃取得到含修炼者和次溴酸根离子的溶液,加入硫酸酸化发生氧化还原反应生成溴单质;
(1)操作X为萃取分液,需要烧杯、分液漏斗等仪器;反萃取时加入20%的NaOH溶液反应生成溴化钠、次溴酸钠和水,反应的离子方程式为:Br2+2OH-=Br-+BrO-+H2O;
故答案为:分液漏斗,Br2+2OH-=Br-+BrO-+H2O;
(2)溴单质易挥发,浓硫酸溶解放热分析,反萃取所得水相酸化时,需缓慢加入浓硫酸,并采用冰水浴冷却的原因是减少溴单质的挥发;
故答案为:减少Br2的挥发;
(3)无有毒气体氯气参加反应,生产过程环保;
故答案为:没有采用有毒气体Cl2,更环保
(4)①硫代硫酸钠溶液滴定碘单质,加入淀粉溶液做指示剂;滴入2~3滴淀粉溶液,再用0.01mol/L Na2S2O3标准溶液滴定至终点;
故答案为;滴入2~3滴淀粉溶液;
②依据化学方程式定量关系计算,将4.5mL 0.02mol/L溴水迅速加入到锥形瓶中,n(Br2)=0.0045L×0.02mol/L=0.00009mol,其中和碘化钾反应的溴单质物质的量
2KI~Br2~I2~2Na2S2O3,;
1 2
n 0.01mol/L×0.015L
n=0.000075mol
与苯酚反应的溴单质=0.00009mol-0.000075mol=0.000015mol
则苯酚物质的量=
×0.000015mol=0.000005mol
该废水中苯酚的含量为=
×0.000005mol×94g/mol=0.0188g/L=18.8mg/L;
③步骤3持续的时间长导致的是KI被氧化,测定苯酚量减少,测定结果偏低;
故答案为:偏低.
(1)操作X为萃取分液,需要烧杯、分液漏斗等仪器;反萃取时加入20%的NaOH溶液反应生成溴化钠、次溴酸钠和水,反应的离子方程式为:Br2+2OH-=Br-+BrO-+H2O;
故答案为:分液漏斗,Br2+2OH-=Br-+BrO-+H2O;
(2)溴单质易挥发,浓硫酸溶解放热分析,反萃取所得水相酸化时,需缓慢加入浓硫酸,并采用冰水浴冷却的原因是减少溴单质的挥发;
故答案为:减少Br2的挥发;
(3)无有毒气体氯气参加反应,生产过程环保;
故答案为:没有采用有毒气体Cl2,更环保
(4)①硫代硫酸钠溶液滴定碘单质,加入淀粉溶液做指示剂;滴入2~3滴淀粉溶液,再用0.01mol/L Na2S2O3标准溶液滴定至终点;
故答案为;滴入2~3滴淀粉溶液;
②依据化学方程式定量关系计算,将4.5mL 0.02mol/L溴水迅速加入到锥形瓶中,n(Br2)=0.0045L×0.02mol/L=0.00009mol,其中和碘化钾反应的溴单质物质的量
2KI~Br2~I2~2Na2S2O3,;
1 2
n 0.01mol/L×0.015L
n=0.000075mol
与苯酚反应的溴单质=0.00009mol-0.000075mol=0.000015mol
则苯酚物质的量=
| 1 |
| 3 |
该废水中苯酚的含量为=
| 1000ml |
| 25ml |
③步骤3持续的时间长导致的是KI被氧化,测定苯酚量减少,测定结果偏低;
故答案为:偏低.
点评:本题考查了废水中物质含量的测定实验探究和物质性质的分析判断,注意滴定实验的过程分析应用,掌握基础是关键,题目难度中等.

练习册系列答案
 核心素养学练评系列答案
核心素养学练评系列答案
相关题目
化学科学需要借助化学专用语言描述,下列有关化学用语正确的是( )
A、CO2的电子式:
| ||||||||||||
B、Cl-的结构示意图 | ||||||||||||
| C、甲烷的结构式 CH4 | ||||||||||||
D、质量数为37的氯原子
|
除杂和配制试剂是中学化学中常见的实验.对实验方法描述正确的是( )
| A、用蒸发结晶法除去KNO3中少量的NaCl |
| B、用加入NaOH(aq)并蒸馏的方法除去乙醛中少量的乙酸 |
| C、准确称取14.800g Ca(OH)2,配制100mL 2.0 mol/L的Ca(OH)2溶液 |
| D、在2mL10%的CuSO4(aq)中滴入3滴 2%的NaOH(aq),配制检验醛基的试剂 |
有甲酸、乙酸和乙二酸组成的混合物a g,经完全燃烧可生成CO20.2mol;完全中和等质量的该混合物消耗80mL 2mol/L的NaOH溶液,则a值可能为( )
| A、8.00 | B、7.92 |
| C、7.90 | D、7.86 |

 结构的有机物可被酸性高锰酸钾溶液氧化成二元醇,如:CH2=CH2
结构的有机物可被酸性高锰酸钾溶液氧化成二元醇,如:CH2=CH2 )为原料合成环状化合物F和高分子化合物E和G.
)为原料合成环状化合物F和高分子化合物E和G.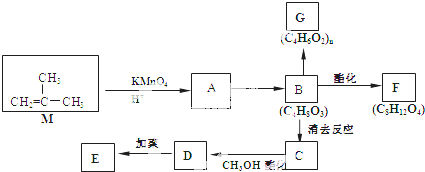
 某稀硫酸和硝酸的混合溶液200mL,分成两份.向其中一份逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO).向另一份逐渐加入铁粉,产生气体的量随铁粉质量增加的变化曲线如图所示.
某稀硫酸和硝酸的混合溶液200mL,分成两份.向其中一份逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO).向另一份逐渐加入铁粉,产生气体的量随铁粉质量增加的变化曲线如图所示.