题目内容
18.放热反应一定是( )| A. | 反应物的总能量高于生成物的总能量 | |
| B. | 反应物的总能量低于生成物的总能量 | |
| C. | 贮存能量 | |
| D. | 断开反应物中的化学键吸收的能量比形成生成物中的化学键放出的能量多 |
分析 反应过程中遵循能量守恒,反应的热量变化和反应物、生成物能量高低有关,当反应物能量高于生成物,反应为放热反应,当反应物能量低于生成物,反应为吸热反应,吸热过程是储存能量的过程,放热过程是释放储存的能量,从化学键断裂和形成分析,断裂化学键吸收能量,形成化学键放出能量,放出能量大于吸收能量发生的反应为放热反应,据此分析判断.
解答 解:A.放热反应一定是反应物的总能量高于生成物的总能量,故A正确;
B.反应物的总能量低于生成物的总能量的反应为吸热反应,故B错误;
C.放热反应一定是释放能量的过程,故C错误;
D.断开反应物中的化学键吸收的能量比形成生成物中的化学键放出的能量少,反应为放热反应,故D错误;
故选A.
点评 本题考查了化学反应实质、反应能量变化、主要是对化学反应能量变化实质的理解应用,掌握基础是解题关键,题目难度不大.

练习册系列答案
相关题目
9.反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,下列说法正确是( )

| A. | 该反应是吸热反应 | |
| B. | 当反应达到平衡时,升高温度,A的转化率减小 | |
| C. | 反应体系中加入催化剂对反应热是有影响 | |
| D. | 在反应体系中加入催化剂,反应速率增大,E1和E2的变化也增大 |
6.对于反应A(g)+3B(g)?2C(g)+2D(g),下列四个数据是在不同条件下测出的该反应的化学反应速率,其中最快的是( )
| A. | v(D)=0.4mol/(L•S) | B. | v(C)=30mol/(L•min) | C. | v (B)=30mol/(L•min) | D. | v(A)=0.15mol/(L•S) |
13.有机物 在不同条件下至少可能发生7种不同类型的反应:①取代 ②加成 ③消去 ④氧化 ⑤酯化 ⑥加聚 ⑦缩聚,其中由于其分子结构中含有-OH,可能发生的反应有( )
在不同条件下至少可能发生7种不同类型的反应:①取代 ②加成 ③消去 ④氧化 ⑤酯化 ⑥加聚 ⑦缩聚,其中由于其分子结构中含有-OH,可能发生的反应有( )
 在不同条件下至少可能发生7种不同类型的反应:①取代 ②加成 ③消去 ④氧化 ⑤酯化 ⑥加聚 ⑦缩聚,其中由于其分子结构中含有-OH,可能发生的反应有( )
在不同条件下至少可能发生7种不同类型的反应:①取代 ②加成 ③消去 ④氧化 ⑤酯化 ⑥加聚 ⑦缩聚,其中由于其分子结构中含有-OH,可能发生的反应有( )| A. | ②④⑥⑦ | B. | ③④⑤⑥ | C. | ②③④⑤ | D. | ①③④⑤⑦ |
10.某同学通过向FeI2溶液中滴加某些试剂的方法证明还原性:I->Fe2+>Br-,下列试剂肯定不需要使用的是( )
| A. | 淀粉 | B. | 溴水 | C. | 氯水 | D. | KSCN |
11.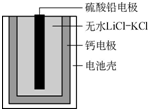 热激活电池可用作火箭、导弹的工作电源.该电池以Ca为负极,熔融无水LiCl-KCl混合物作电解质,结构如图所示.正极反应式为PbSO4+2Li++2e-═Li2SO4+Pb.下列说法不正确的是( )
热激活电池可用作火箭、导弹的工作电源.该电池以Ca为负极,熔融无水LiCl-KCl混合物作电解质,结构如图所示.正极反应式为PbSO4+2Li++2e-═Li2SO4+Pb.下列说法不正确的是( )
 热激活电池可用作火箭、导弹的工作电源.该电池以Ca为负极,熔融无水LiCl-KCl混合物作电解质,结构如图所示.正极反应式为PbSO4+2Li++2e-═Li2SO4+Pb.下列说法不正确的是( )
热激活电池可用作火箭、导弹的工作电源.该电池以Ca为负极,熔融无水LiCl-KCl混合物作电解质,结构如图所示.正极反应式为PbSO4+2Li++2e-═Li2SO4+Pb.下列说法不正确的是( )| A. | 该电池总反应为PbSO4+2LiCl+Ca═CaCl2+Li2SO4+Pb | |
| B. | 放电过程中,Li+向正极移动 | |
| C. | 每转移0.1mol电子,理论上生成20.7gPb | |
| D. | 常温下电解质是不导电的固体,电池不工作 |