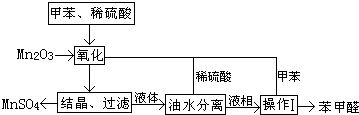
题目内容
氯碱厂电解饱和食盐水制取NaOH的工艺流程图如图所示,依据流程图,完成下列填空:
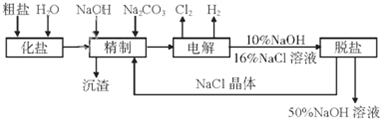
(1)工业食盐含Ca2+、Mg2+等杂质.精制过程中所得沉渣的主要成份是 (填化学式);
(2)如果粗盐中SO42-含量较高,必须添加钡试剂除去SO42-,该钡试剂不可以是 (填选项字母序号):
A.Ba(HCO3)2 B.Ba(NO3)2 C.Ba(OH)2 D.BaCl2
(3)为有效除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为 (选选项字母序号).
A.先加NaOH,后加钡试剂,再加Na2CO3
B.先加NaOH,后加Na2CO3,再加钡试剂
C.先加钡试剂,后加Na2CO3,再加NaOH
(4)通过离子交换膜电解饱和食盐水,与电源正极相连的电极应选择 电极(填“石墨”或“铁”);写出阴极发生的电极反应式 ;
(5)阴极室通入的水中含有少量氢氧化钠,其目的是 ;电解一段时间后,若两极共收集到2.24L气体(气体所处状态为标准状态且不考虑气体在水中的溶解)试计算导线上转移的电子数为 NA.

(1)工业食盐含Ca2+、Mg2+等杂质.精制过程中所得沉渣的主要成份是
(2)如果粗盐中SO42-含量较高,必须添加钡试剂除去SO42-,该钡试剂不可以是
A.Ba(HCO3)2 B.Ba(NO3)2 C.Ba(OH)2 D.BaCl2
(3)为有效除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为
A.先加NaOH,后加钡试剂,再加Na2CO3
B.先加NaOH,后加Na2CO3,再加钡试剂
C.先加钡试剂,后加Na2CO3,再加NaOH
(4)通过离子交换膜电解饱和食盐水,与电源正极相连的电极应选择
(5)阴极室通入的水中含有少量氢氧化钠,其目的是
考点:物质分离和提纯的方法和基本操作综合应用,原电池和电解池的工作原理
专题:实验设计题,电化学专题
分析:(1)Ca2+、Mg2+等杂质与碳酸钠、NaOH反应转化为碳酸钙、氢氧化镁沉淀;
(2)添加钡试剂除去SO42-,不能引入新的杂质,据此对各选项判断;
(3)有效除去Ca2+、Mg2+、SO42-,应注意碳酸钠在钡试剂之后即可;
(4)电解饱和氯化钠溶液时,阳极上氯离子放电生成氯气,阴极上氢离子放电生成氢气,与电源正极相连的电极必须是惰性电极;
(5)加入氢氧化钠溶液可以增大溶液中离子浓度,增强导电能力;根据电解反应计算出气体的物质的量,然后根据电子守恒计算出转移电子数.
(2)添加钡试剂除去SO42-,不能引入新的杂质,据此对各选项判断;
(3)有效除去Ca2+、Mg2+、SO42-,应注意碳酸钠在钡试剂之后即可;
(4)电解饱和氯化钠溶液时,阳极上氯离子放电生成氯气,阴极上氢离子放电生成氢气,与电源正极相连的电极必须是惰性电极;
(5)加入氢氧化钠溶液可以增大溶液中离子浓度,增强导电能力;根据电解反应计算出气体的物质的量,然后根据电子守恒计算出转移电子数.
解答:
解:(1)Ca2+、Mg2+等杂质与碳酸钠、NaOH反应的离子反应分别为:Ca2++CO32-═CaCO3↓、Mg2++2OH-═Mg(OH)2↓,所以沉渣的成分为:CaCO3、Mg(OH)2,
故答案为:CaCO3、Mg(OH)2;
(2)添加钡试剂除去SO42-,注意不能引入新的杂质,选Ba(NO3)2会引入杂质硝酸根离子,其中B.Ba(NO3)2会引进难以除去杂质硝酸根离子,而A.Ba(HCO3)2 C.Ba(OH)2 D.BaCl2,可以加入碳酸钠和盐酸除去剩余杂质,所以不能选用的为B,
故答案为:B;
(3)有效除去Ca2+、Mg2+、SO42-,应注意碳酸钠在钡试剂之后,是为除去过量的钡离子,所以可先加NaOH,后加钡试剂,再加Na2CO3,也可以先加钡试剂,后加Na2CO3,再加NaOH,所以AC正确,
故答案为:AC;
(4)电解饱和食盐水时,与电源正极相连的电极上氯离子失电子发生氧化反应,电极反应式为为:2Cl--2e-=Cl2↑,则正极材料必须为惰性电极,可以为石墨,不能用铁做正极;电解池中阴极水电离的氢离子得到电子生成氢气,电极反应式为:2H2O+2e-=H2↑+2OH-,
故答案为:石墨;2H2O+2e-=H2↑+2OH-;
(5)阴极室通入的水中含有少量氢氧化钠,可以增大离子浓度,增强溶液的导电能力;
电解饱和食盐水生成氢氧化纳、氢气和氯气:2NaCl+2H2O
2NaOH+H2↑+Cl2↑,标况下2.24L气体的物质的量为:
=0.1mol,根据反应可知,生成氢气和氢气的物质的量各为0.05mol,生成0.05mol氯气转移0.1mol电子,转移的电子为:0.1NA,
故答案为:增大离子浓度,增强导电能力;0.1.
故答案为:CaCO3、Mg(OH)2;
(2)添加钡试剂除去SO42-,注意不能引入新的杂质,选Ba(NO3)2会引入杂质硝酸根离子,其中B.Ba(NO3)2会引进难以除去杂质硝酸根离子,而A.Ba(HCO3)2 C.Ba(OH)2 D.BaCl2,可以加入碳酸钠和盐酸除去剩余杂质,所以不能选用的为B,
故答案为:B;
(3)有效除去Ca2+、Mg2+、SO42-,应注意碳酸钠在钡试剂之后,是为除去过量的钡离子,所以可先加NaOH,后加钡试剂,再加Na2CO3,也可以先加钡试剂,后加Na2CO3,再加NaOH,所以AC正确,
故答案为:AC;
(4)电解饱和食盐水时,与电源正极相连的电极上氯离子失电子发生氧化反应,电极反应式为为:2Cl--2e-=Cl2↑,则正极材料必须为惰性电极,可以为石墨,不能用铁做正极;电解池中阴极水电离的氢离子得到电子生成氢气,电极反应式为:2H2O+2e-=H2↑+2OH-,
故答案为:石墨;2H2O+2e-=H2↑+2OH-;
(5)阴极室通入的水中含有少量氢氧化钠,可以增大离子浓度,增强溶液的导电能力;
电解饱和食盐水生成氢氧化纳、氢气和氯气:2NaCl+2H2O
| ||
| 2.24L |
| 22.4L/mol |
故答案为:增大离子浓度,增强导电能力;0.1.
点评:本题考查物质分离、提纯方法及化学实验基本操作方法的综合应用,题目难度中等,涉及粗盐提纯及电解原理等知识,明确发生的离子反应及电解反应是解答的关键,注意除杂不能引入新的杂质及试剂的添加顺序,试题有利于培养学生的分析、理解能力及化学实验能力.

练习册系列答案
相关题目
氯气是一种重要的工业原料.工业上利用反应3Cl2+2NH3=N2+6HCl检查氯气管道是否漏气,若管道漏气遇氨就会产生白烟.下列说法错误的是( )
| A、白烟的成分为NH4Cl晶体颗粒 |
| B、该反应属于复分解反应 |
| C、该反应利用了Cl2的强氧化性 |
| D、生成1molN2有6mol电子转移 |
由二氧化硅制高纯硅的流程图如图,下列判断中错误的是( )
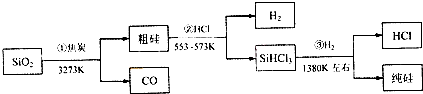

| A、①②③均属于氧化还原反应 |
| B、H2和HCl均可循环利用 |
| C、SiO2是一种坚硬难熔的固体 |
| D、光纤的主要成分是高纯度的单质硅 |