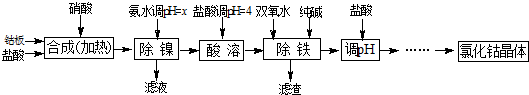
题目内容
A、B、C、D、E是五种短周期元素.已知:它们的原子序数依次增大,A是元素周期表中原子半径最小的元素;B原子最外层电子数比其次外层电子数多2,C是E的邻族元素;D和E的原子序数之和为30,且D的族序数与周期数相等.甲、乙、丙、丁是它们两两形成的化合物,其中甲分子中含有18个电子.
请回答下列问题:
(1)C的氢化物与乙相比较,稳定性强弱关系(用相应的化学式表示): > ;
(2)元素E在周期表中的位置为第 周期 族;
(3)请写出两种与乙具有相同电子数的非单核离子的化学式: 和 ;
(4)把D的单质放到NaOH溶液中,反应的化学方程式为: ;
(5)写出甲的电子式: ;
(6)有200mL MgCl2和丙的混合溶液,其中c(Mg2+)=0.2mol?L-1,c(Cl-)=1.3mol?L-1,要使Mg2+全部转化为沉淀分离出来,至少需要4mol?L-1 NaOH 溶液的体积是: .
| 物质组成 | 甲 | 乙 | 丙 | 丁 |
| 化合物中各元素 原子个数比 | A和C 1:1 | B和A 1:4 | D和E 1:3 | B和E 1:4 |
(1)C的氢化物与乙相比较,稳定性强弱关系(用相应的化学式表示):
(2)元素E在周期表中的位置为第
(3)请写出两种与乙具有相同电子数的非单核离子的化学式:
(4)把D的单质放到NaOH溶液中,反应的化学方程式为:
(5)写出甲的电子式:
(6)有200mL MgCl2和丙的混合溶液,其中c(Mg2+)=0.2mol?L-1,c(Cl-)=1.3mol?L-1,要使Mg2+全部转化为沉淀分离出来,至少需要4mol?L-1 NaOH 溶液的体积是:
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A、B、C、D、E是五种短周期元素,它们的原子序数依次增大,A是元素周期表中原子半径最小的元素,则A氢元素;B原子最外层电子数比其次外层电子数多2,则B碳元素,D的族序数与周期数相等,且D的原子序数大于B,同D为铝元素,D和E的原子序数之和为30,则E为氯元素,C是E的邻族元素,即为第ⅥA族元素,且原子序数介于B、D之间,则C为氧元素,甲分子中含有18个电子,根据表格中各物质中的原子个数比可知,甲为双氧水,乙为甲烷,丙为氯化铝,丁为四氯化碳,据此答题.
解答:
解:A、B、C、D、E是五种短周期元素,它们的原子序数依次增大,A是元素周期表中原子半径最小的元素,则A氢元素;B原子最外层电子数比其次外层电子数多2,则B碳元素,D的族序数与周期数相等,且D的原子序数大于B,同D为铝元素,D和E的原子序数之和为30,则E为氯元素,C是E的邻族元素,即为第ⅥA族元素,且原子序数介于B、D之间,则C为氧元素,甲分子中含有18个电子,根据表格中各物质中的原子个数比可知,甲为双氧水,乙为甲烷,丙为氯化铝,丁为四氯化碳,
(1)因为氧的非金属性强于碳,所以水的稳定性强于甲烷,故答案为:H2O;CH4;
(2)E为氯元素,在周期表中第三周期VIIA族,故答案为:三;VIIA;
(3)乙有10个电子,则含10个电子的非单核离子的化学式为NH4+和OH-,故答案为:NH4+;OH-;
(4)把铝的单质放到NaOH溶液中,反应的化学方程式为2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑,故答案为:2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑;
(5)甲为双氧水,它的电子式为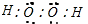 ,故答案为:
,故答案为: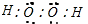 ;
;
(6)有200mL MgCl2和AlCl3的混合溶液,其中c(Mg2+)=0.2mol?L-1,c(Cl-)=1.3mol?L-1,则c(Al3+)=0.3mol?L-1,要使Mg2+全部转化为沉淀分离出来,此时Al3+要生成AlO2-,需要NaOH 物质的量为0.3×0.2×4+0.2×0.2×2mol=0.32mol,所以溶液的体积为
×1000mL=80 mL,
故答案为:80 mL.
(1)因为氧的非金属性强于碳,所以水的稳定性强于甲烷,故答案为:H2O;CH4;
(2)E为氯元素,在周期表中第三周期VIIA族,故答案为:三;VIIA;
(3)乙有10个电子,则含10个电子的非单核离子的化学式为NH4+和OH-,故答案为:NH4+;OH-;
(4)把铝的单质放到NaOH溶液中,反应的化学方程式为2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑,故答案为:2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑;
(5)甲为双氧水,它的电子式为
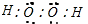 ,故答案为:
,故答案为: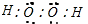 ;
;(6)有200mL MgCl2和AlCl3的混合溶液,其中c(Mg2+)=0.2mol?L-1,c(Cl-)=1.3mol?L-1,则c(Al3+)=0.3mol?L-1,要使Mg2+全部转化为沉淀分离出来,此时Al3+要生成AlO2-,需要NaOH 物质的量为0.3×0.2×4+0.2×0.2×2mol=0.32mol,所以溶液的体积为
| 0.32 |
| 4 |
故答案为:80 mL.
点评:本题主要考查了物质的性质、10电子结构、电子式、化学方程式及相关计算,中等难度,解题的关键在于根据原子结构确定元素种类.

练习册系列答案
 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案
相关题目
设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A、物质的量浓度为1 mol/L的K2SO4溶液中,含2 NA个K+ |
| B、把40 g NaOH固体溶于1 L水中,所得溶液中NaOH的物质的量浓度为1 mol?L-1 |
| C、常温常压下,71 g Cl2含有2 NA个Cl原子 |
| D、标准状况下,11.2 L 氦气中含有的原子数为NA |
海藻中含有丰富的碘元素.如图是实验室从海藻里提取碘的流程的一部分.下列判断正确的是( )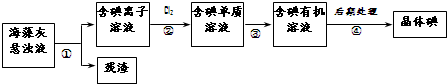

| A、步骤④的操作是过滤 |
| B、可用淀粉溶液检验步骤②的反应是否进行完全 |
| C、步骤①、③的操作分别是过滤、萃取 |
| D、步骤③中加入的有机溶剂可能是酒精或CCl4 |
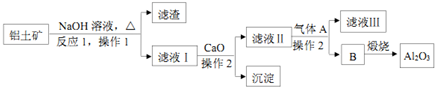
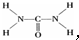 ,
,