题目内容
恒温、恒压下,在一个容积可变的容器中发生如下反应:N2(g)+3H2(g)?2NH3(g)
(1)若开始时放入1mol N2和3molH2,达到平衡后,生成a mol NH3,这时N2的物质的量为 mol;
(2)若开始时无NH3,只放入N2和H2,达到平衡时生成NH3的物质的量为3a mol,则开始时放入N2和H2的物质的量分别为 mol和 mol;
(3)若开始时放入x mol N2、6molH2和2molNH3,达到平衡后,N2和NH3的物质的量分别为y mol和3a mol,则x= ,y= ,平衡时H2的物质的量 (选填一个编号)作,出判断的理由是 ;
A.大于6mol B.等于6mol C.小于6mol D.可能大于、小于或等于6mol
(4)若在(3)的平衡混合物中,再加入6molNH3,再次达到平衡后,NH3的质量分数为 .
(1)若开始时放入1mol N2和3molH2,达到平衡后,生成a mol NH3,这时N2的物质的量为
(2)若开始时无NH3,只放入N2和H2,达到平衡时生成NH3的物质的量为3a mol,则开始时放入N2和H2的物质的量分别为
(3)若开始时放入x mol N2、6molH2和2molNH3,达到平衡后,N2和NH3的物质的量分别为y mol和3a mol,则x=
A.大于6mol B.等于6mol C.小于6mol D.可能大于、小于或等于6mol
(4)若在(3)的平衡混合物中,再加入6molNH3,再次达到平衡后,NH3的质量分数为
考点:化学平衡的计算,化学平衡的影响因素
专题:化学平衡专题
分析:先利用达平衡后,生成amolNH3,计算参加反应的物质的物质的量,可计算出平衡时氮气的物质的量;根据温度不变,利用极限转化为反应物的物质的量与起始量的关系及平衡时NH3的质量分数都相同来计算.
解答:
解:(1)设生成amolmolNH3转化的N2的物质的量为y,则
N2+3H2 2NH3,
2NH3,
1 2
y amol
=
,y=
mol,
则平衡时氮气的物质的量为1mol-
mol=
mol,
故答案为:
;
(2)又在恒温恒压条件1molN2与3molH2的混合气体通入一个容积可变的容器中发生反应,达平衡后,生成a molNH3,
则只通入N2与H2,达平衡时生成3amolNH3,则开始时应通入N23mol,且平衡时NH3 的质量分数与前者相同,
及极限转化后起始的量与原起始量成正比,故H2的物质的量为3mol×3=9mol,故答案为:3;9;
(3)若开始时通入x molN2﹑6molH2和2molNH3,将2molNH3极限转化为反应物,则相当于开始加入(x+1)molN2﹑(6+3)molH2,
达平衡后,NH3的物质的量3amol,
则(x+1)mol:(6+3)mol=1:3,解得x=2mol,
由恒温恒压条件,两种情况中起始的反应物的物质的量成正比,则平衡时各物质的含量成正比,
则1molN2与3molH2的混合气体通入发生反应时平衡时氮气的物质的量为
mol,
故开始时通入2molN2﹑6molH2和2molNH3的混合气体通入发生反应时平衡时氮气的物质的量为
mol×3=
mol,
由x=2得开始时通入2 molN2﹑6molH2和2molNH3,平衡时NH3的物质的量3a,则无法判断氨气开始的2mol与平衡时的3amol谁大,故不知道平衡到底向什么方向移动,所以应选D;
故答案为:2;
;D;无法判断氨气开始的2mol与平衡时的3amol谁大;
(4)若在(3)的平衡混合物中,再加入6molNH3,相当于成比例增大反应物,恒温、恒压下等效,故再次达到平衡后NH3的质量分数与原平衡相同,即NH3的质量分数=
×100%=50a%,故答案:50a%.
N2+3H2
 2NH3,
2NH3,1 2
y amol
| 1 |
| y |
| 2 |
| a |
| a |
| 2 |
则平衡时氮气的物质的量为1mol-
| a |
| 2 |
| 2-a |
| 2 |
故答案为:
| 2-a |
| 2 |
(2)又在恒温恒压条件1molN2与3molH2的混合气体通入一个容积可变的容器中发生反应,达平衡后,生成a molNH3,
则只通入N2与H2,达平衡时生成3amolNH3,则开始时应通入N23mol,且平衡时NH3 的质量分数与前者相同,
及极限转化后起始的量与原起始量成正比,故H2的物质的量为3mol×3=9mol,故答案为:3;9;
(3)若开始时通入x molN2﹑6molH2和2molNH3,将2molNH3极限转化为反应物,则相当于开始加入(x+1)molN2﹑(6+3)molH2,
达平衡后,NH3的物质的量3amol,
则(x+1)mol:(6+3)mol=1:3,解得x=2mol,
由恒温恒压条件,两种情况中起始的反应物的物质的量成正比,则平衡时各物质的含量成正比,
则1molN2与3molH2的混合气体通入发生反应时平衡时氮气的物质的量为
| 2-a |
| 2 |
故开始时通入2molN2﹑6molH2和2molNH3的混合气体通入发生反应时平衡时氮气的物质的量为
| 2-a |
| 2 |
| 6-3a |
| 2 |
由x=2得开始时通入2 molN2﹑6molH2和2molNH3,平衡时NH3的物质的量3a,则无法判断氨气开始的2mol与平衡时的3amol谁大,故不知道平衡到底向什么方向移动,所以应选D;
故答案为:2;
| 6-3a |
| 2 |
(4)若在(3)的平衡混合物中,再加入6molNH3,相当于成比例增大反应物,恒温、恒压下等效,故再次达到平衡后NH3的质量分数与原平衡相同,即NH3的质量分数=
| 17ag |
| 28g+6g |
点评:本题考查了化学平衡的建立过程,注意等效平衡知识的理解及应用,本题难度中等.

练习册系列答案
 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案
相关题目
下列实验操作中,不合理的是( )
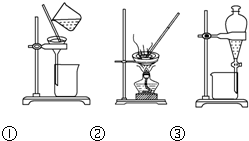

| A、洗涤沉淀时(如图①),向漏斗中加适量水,搅拌并滤干 | ||
| B、用CCl4提取碘水中的碘,选③ | ||
C、蒸馏时蒸馏烧瓶中液体的体积不能超过容积的
| ||
| D、粗盐提纯,选①和② |
30g某一元醇与足量的金属钠完全反应,在标准状况下得到5.6L氢气.该物质可能是( )
| A、CH3OH |
| B、C2H5OH |
| C、C3H7OH |
| D、C4H9OH |
下列对有关实验的描述不正确的是( )
| A、在浓氨水中加入生石灰可以制取少量的NH3 | ||||
B、用惰性电极电解熔融NaCl:2Cl-+2H2O
| ||||
| C、氯水和活性炭使红墨水褪色,能用同一原理解释 | ||||
| D、浓硫酸和浓盐酸长期暴露在空气中浓度都会降低 |
有人研究证明:使用氯气作自来水消毒剂,氯气会与水中有机物反应,生成如CHCl3等物质,这些物质可能是潜在的致癌致畸物质.目前人们已研发多种饮用水的新型消毒剂.下列物质不能作自来水消毒剂的是( )
| A、明矾 |
| B、二氧化氯 |
| C、臭氧 |
| D、高铁酸钠( Na2FeO4) |
下列装置或操作能达到实验目的是( )
A、 除去乙醇中的乙酸 |
B、 形成原电池 |
C、 制取乙酸乙酯 |
D、 石油的分馏 |
对于一定条件下进行的化学反应:2SO2+O2???2SO3,改变下列条件,可以提高反应物中活化分子百分数的是( )①增大压强 ②升高温度 ③加入催化剂 ④减小反应物浓度.
| A、①② | B、②③ | C、①②③ | D、①④ |
pH值测定是检验物质的常用方法,下列有关pH值测定的实验合理的是( )
| A、将失去标签的Na2CO3和NaHCO3固体样品配成等物质的量浓度溶液,分别测定pH值,以此鉴别这两种固体 |
| B、用pH试纸分别测定氯水和盐酸的pH值,比较两溶液的酸性强弱 |
| C、取同体积不同浓度的醋酸和盐酸加水稀释相同倍数,测定稀释前后pH值的变化,以此区别这两种酸 |
| D、测定硫酸型酸雨的pH值时,取样后应立即测定 |