题目内容
钙元素是人体必需的常量元素,所有的细胞都需要钙元素.正常人体血液中钙离子浓度为2.2×10-3mol/L--2.7×10-3mol/L.某病人血样 10mL,稀释后用草酸铵[(NH4)2C2O4]溶液处理,使Ca2+完全转变为草酸钙(CaC2O4)沉淀,过滤、洗涤、干燥,将得到的沉淀用含稀硫酸的5.0×10-3mol/L KMnO4溶液氧化,消耗2.0mL KMnO4溶液时,恰好把C2
完全氧化为CO2,同时Mn
被还原为Mn2+.
(1)根据上述信息可知,1mol KMnO4可氧化CaC2O4 mol.
(2)写出配平CaC2O4被KMnO4溶液(H2SO4酸化)氧化的化学方程式. .
(3)根据上述反应方程式可计算出该病人血液中钙离子浓度为 .
| O | 2- 4 |
| O | - 4 |
(1)根据上述信息可知,1mol KMnO4可氧化CaC2O4
(2)写出配平CaC2O4被KMnO4溶液(H2SO4酸化)氧化的化学方程式.
(3)根据上述反应方程式可计算出该病人血液中钙离子浓度为
考点:难溶电解质的溶解平衡及沉淀转化的本质
专题:电离平衡与溶液的pH专题
分析:(1)将得到的沉淀用含稀硫酸的5.0×10-3mol/L KMnO4溶液氧化,消耗2.0mL KMnO4溶液时,恰好把C2
完全氧化为CO2,同时Mn
被还原为Mn2+,根据转移电子数相等求算;
(2)用化合价升降法配平方程式;
(3)根据方程式计算草酸钙的物质的量,根据元素守恒可知血液中钙离子物质的量再计算浓度.
| O | 2- 4 |
| O | - 4 |
(2)用化合价升降法配平方程式;
(3)根据方程式计算草酸钙的物质的量,根据元素守恒可知血液中钙离子物质的量再计算浓度.
解答:
解:(1)Mn
被还原为Mn2+,则1mol高锰酸根共得到5mol电子,把C2
完全氧化为CO2,则1mol草酸钙被氧化,转移2mol电子,设备氧化的草酸钙的物质的量为x,根据得失电子守恒得:1×5=2×x,解得:x=2.5,故答案为:2.5;
(2)根据已知写出反应物和生成物:CaC2O4+KMnO4+H2SO4→CO2↑+MnSO4+CaSO4+K2SO4+H2O,
反应中Mn化合价从+7→+2,降低5价,C化合价从+3→+4,升高1价,一个草酸钙含两个C,共升高2价,最小公倍数为10,故Mn前面系数为2,草酸钙系数为5,
二氧化碳系数为10,再用质量守恒配平其他物质,配平后方程式为:5CaC2O4+2KMnO4+8H2SO4=10CO2↑+2MnSO4+5CaSO4+K2SO4+8H2O;
故答案为:5CaC2O4+2KMnO4+8H2SO4=10CO2↑+2MnSO4+5CaSO4+K2SO4+8H2O;
(3)消耗高锰酸钾的物质的量为:5.0×10-3mol/L×0.002L=1×10-5mol,根据反应方程式5CaC2O4+2KMnO4+8H2SO4=10CO2↑+2MnSO4+5CaSO4+K2SO4+8H2O,可知草酸钙的物质的量为:1×10-5mol×
=2.5×10-5mol,血液中钙离子物质的量为:2.5×10-5mol,浓度为:
mol=2.5×10-3 mol/L;
故答案为:2.5×10-3 mol/L.
| O | - 4 |
| O | 2- 4 |
(2)根据已知写出反应物和生成物:CaC2O4+KMnO4+H2SO4→CO2↑+MnSO4+CaSO4+K2SO4+H2O,
反应中Mn化合价从+7→+2,降低5价,C化合价从+3→+4,升高1价,一个草酸钙含两个C,共升高2价,最小公倍数为10,故Mn前面系数为2,草酸钙系数为5,
二氧化碳系数为10,再用质量守恒配平其他物质,配平后方程式为:5CaC2O4+2KMnO4+8H2SO4=10CO2↑+2MnSO4+5CaSO4+K2SO4+8H2O;
故答案为:5CaC2O4+2KMnO4+8H2SO4=10CO2↑+2MnSO4+5CaSO4+K2SO4+8H2O;
(3)消耗高锰酸钾的物质的量为:5.0×10-3mol/L×0.002L=1×10-5mol,根据反应方程式5CaC2O4+2KMnO4+8H2SO4=10CO2↑+2MnSO4+5CaSO4+K2SO4+8H2O,可知草酸钙的物质的量为:1×10-5mol×
| 5 |
| 2 |
| 2.5×10-5 |
| 0.01L |
故答案为:2.5×10-3 mol/L.
点评:本题考查了氧化还原反应的配平及计算,中等难度,守恒法是常用的解题方法.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
如图所示装置可以用来发生、洗涤、干燥、收集(不考虑尾气处理)气体,该装置可用于( )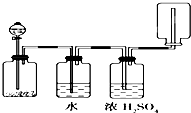

| A、KMnO4分解生成氧气 |
| B、二氧化锰和盐酸生产氯气 |
| C、碳酸钙和盐酸生成二氧化碳 |
| D、锌和盐酸生成氢气 |

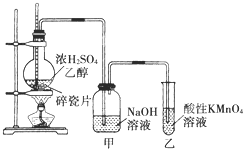 如图是一套实验室制取乙烯并验证乙烯具有还原性的实验装置.
如图是一套实验室制取乙烯并验证乙烯具有还原性的实验装置.