题目内容
关于化学键的下列叙述中,正确的是( )
| A、所有物质中都含有化学键 |
| B、共价化合物中可能含离子键 |
| C、离子化合物中只含离子键 |
| D、离子化合物中可能含共价键 |
考点:化学键
专题:化学键与晶体结构
分析:A.单原子构成的分子中不存在化学键;
B.含离子键的一定为离子化合物;
C.离子化合物中可存在共价键;
D.离子化合物一定含离子键,可能存在共价键.
B.含离子键的一定为离子化合物;
C.离子化合物中可存在共价键;
D.离子化合物一定含离子键,可能存在共价键.
解答:
解:A.单原子构成的分子中不存在化学键,不是所有物质中都含有化学键,故A错误;
B.含离子键的一定为离子化合物,则共价化合物中一定不含离子键,故B错误;
C.离子化合物中可存在共价键,如NaOH等,故C错误;
D.离子化合物一定含离子键,可能存在共价键,如NaCl、NaOH等均为离子化合物,故D正确;
故选D.
B.含离子键的一定为离子化合物,则共价化合物中一定不含离子键,故B错误;
C.离子化合物中可存在共价键,如NaOH等,故C错误;
D.离子化合物一定含离子键,可能存在共价键,如NaCl、NaOH等均为离子化合物,故D正确;
故选D.
点评:本题考查化学键,为高频考点,把握化学键的形成及化合物中的化学键判断为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案
相关题目
体硼是由
B和
B两种同位素构成的.已知5.4克晶体硼(B)全部氢化生成B2H6 (硼烷)气体时,可得标准状况下5.6L硼烷,则晶体硼中
B和
B两种核素的原子个数比是( )
10 5 |
11 5 |
10 5 |
11 5 |
| A、1:1 | B、1:3 |
| C、1:4 | D、1:2 |
下列各组元素中,按照从左到右的顺序,原子序数递增、元素最高化合价也递增的是( )
| A、H、C、Na、Mg |
| B、Mg、Al、S、Cl |
| C、H、Li、Na、K |
| D、C、O、S、Si |
以下关于氨碱法与联合制碱法的认识,不正确的是( )
| A、联合制碱法又称侯氏制碱法,是将氨碱法与合成氨联合生产的改进工艺 |
| B、与氨碱法相比,联合制碱法不产生难以处理的CaCl2,同时可生产出NH4Cl作氮肥 |
| C、联合制碱法中的CO2来源于合成氨工业的废气,氨碱法中的CO2来源于石灰石煅烧 |
| D、联合制碱法保留了氨碱法的优点,消除了它的缺点,使氯化钠的利用率达到了100% |
现有个体积为2L的绝热(与外界无热量交换)密闭容器Ⅰ和Ⅱ,在Ⅰ中充入1molN2 和3molH2 ,在Ⅱ中充入2mol NH3 ,均在500℃条件下开始发生反应:N2(g)+3H2(g)═2NH3(g)△H=-92.3kJ/mol,一段时间后均达到平衡状态,下列说法合理的是( )
| A、因平衡常数之和温度有关,所以容器Ⅰ和Ⅱ的平衡常数相等 |
| B、若容器Ⅰ经过10min达平衡,测得n(NH3)=0.4mol.则v(N2)=0.02mol?L-1?min-1 |
| C、达平衡后,容器Ⅰ中放出的能量和容器Ⅱ中所吸收的能量之和刚好为92.3kJ |
| D、达平衡后,容器Ⅰ中NH3的物质的量比容器中的少 |
下列各种叙述中不正确的是( )
| A、共价化合物里,一定不存在离子键 |
| B、在离子化合物里,只存在离子键 |
| C、化学键可以使离子结合,也可以使原子结合 |
| D、在化学反应过程中,反应物分子内的化学键断裂 |
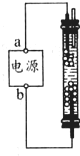 某学生想制作一种家作环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl2被完全吸收制得有较强杀菌能力的消毒液,设计了如图所示的装置,以下对电源电极名称和消毒液的主要成份判断正确的是( )
某学生想制作一种家作环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl2被完全吸收制得有较强杀菌能力的消毒液,设计了如图所示的装置,以下对电源电极名称和消毒液的主要成份判断正确的是( )| A、a为正极,b为负极;NaClO和NaCl |
| B、a为负极,b为正极;NaClO和NaCl |
| C、a为阳极,b为阴极;NaClO和NaCl |
| D、a为阳极,b为阴极;NaClO和NaCl |