题目内容
13.下列元素能形成XY2型化合物的是( )①原子序数分别为6和16的元素,
②核内质子数分别为14和8的元素,
③外围电子排布式分别是3s2和3s23p5的基态原子,
④轨道表示式分别为如图的两种元素的基态原子:

| A. | ①②③④ | B. | 只有①②③ | C. | 只有② | D. | 只有① |
分析 根据元素的原子序数和电子排布推断出具体的元素,根据元素的化合价判断所形成的化合物,据此进行分析解答.
解答 解:①6号元素为碳,16号元素为S,C和S可形成化合物CS2,符合XY2型,故正确.
②核内质子数分别为14和8的元素,为Si、O,Si、O可形成化合物SiO2,能形成XY2型化合物,故正确.
③外围电子排布式分别是3s2和3s23p5的基态原子,为Mg和Cl,可形成化合物MgCl2,能形成XY2型化合物,故正确.
④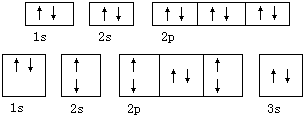 分别为Ne、Mg,Ne不能与Mg结合形成化合物,故错误.
分别为Ne、Mg,Ne不能与Mg结合形成化合物,故错误.
故选:B.
点评 本题考查了元素的原子序数、质子数、电子排布,根据原子序数、质子数、电子排布推断出元素符号再根据化合价分析,掌握电子排布式是正确解答本题的关键,题目难度不大.

练习册系列答案
 寒假学与练系列答案
寒假学与练系列答案
相关题目
15.下列各项对应的电离方程式或离子方程式书写正确的是( )
| A. | NaHSO4熔融态的电离:NaHSO4═Na++HSO4- | |
| B. | NaHCO3在水中电离:NaHCO3═Na++H++CO32- | |
| C. | Cu(OH)2溶于硫酸溶液:H++OH-═H2O | |
| D. | 实验室制取CO2:CO32-+2H+═CO2↑+H2O |
5.通过实验观察,某气体有下列性质:①有刺激性气味,②可使品红溶液褪色,③溶于水,溶液能使蓝色石蕊试纸变红,④通入浓硝酸中,无红棕色气体产生,据此,该气体可能是( )
| A. | HCl | B. | Cl2 | C. | SO2 | D. | NH3 |
3.如图是部分短周期元素原子半径与原子序数的关系图.则下列说法正确的是( )


| A. | Z、N两种元素的离子半径相比,前者较大 | |
| B. | 工业上可通过电解熔融的Z 和N组成的化合物来制取Z单质 | |
| C. | 由X与M两种元素组成的化合物不能与任何酸反应,但能与强碱反应 | |
| D. | Z的氧化物能分别溶解于Y的氢氧化物和N的氢化物的水溶液 |




 )是一种化工原料,其合成路线如下:
)是一种化工原料,其合成路线如下:
 (填结构简式).
(填结构简式).