题目内容
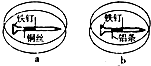 如图所示,将紧紧缠绕不同金属的铁钉放入培养皿中,再加入含有适量酚酞和
如图所示,将紧紧缠绕不同金属的铁钉放入培养皿中,再加入含有适量酚酞和NaCl的琼脂热溶液,冷却后形成琼胶(离子在琼胶内可以移动),下列叙述正确的是( )
| A、a中铁钉发生还原反应 |
| B、b中铁钉附近呈现红色 |
| C、a中铜丝附近呈现蓝色 |
| D、b中铝条附近有气泡产生 |
考点:金属的电化学腐蚀与防护
专题:电化学专题
分析:A、a中构成的是铁铜原电池,铁作为负极,发生氧化反应;
B、b中形成原电池,铁钉做正极,发生铝条的吸氧腐蚀;
C、a中形成原电池,铁做负极,发生铁钉的吸氧腐蚀;
D、b中形成原电池,铁钉做正极,铝条做负极,发生铝条的吸氧腐蚀.
B、b中形成原电池,铁钉做正极,发生铝条的吸氧腐蚀;
C、a中形成原电池,铁做负极,发生铁钉的吸氧腐蚀;
D、b中形成原电池,铁钉做正极,铝条做负极,发生铝条的吸氧腐蚀.
解答:
解:A、a中构成的是铁铜原电池,铁作为负极,发生氧化反应,故A错误;
B、b中形成原电池,发生铝条的吸氧腐蚀,铝条做负极:Al-3e-=Al3+,铁钉做正极,氧气在正极放电:O2+4e-+2H2O=4OH-,生成氢氧根,故铁钉附近变红,故B正确;
C、a中形成原电池,铁做负极,铜丝做正极,不会参与反应,故铜丝附近不会出现蓝色,故C错误;
D、b中形成原电池,铁钉做正极,氧气在正极放电:O2+4e-+2H2O=4OH-;铝条做负极,电极反应为:Al-3e-=Al3+,故铝条附近不会产生气泡,故D错误;
故选B.
B、b中形成原电池,发生铝条的吸氧腐蚀,铝条做负极:Al-3e-=Al3+,铁钉做正极,氧气在正极放电:O2+4e-+2H2O=4OH-,生成氢氧根,故铁钉附近变红,故B正确;
C、a中形成原电池,铁做负极,铜丝做正极,不会参与反应,故铜丝附近不会出现蓝色,故C错误;
D、b中形成原电池,铁钉做正极,氧气在正极放电:O2+4e-+2H2O=4OH-;铝条做负极,电极反应为:Al-3e-=Al3+,故铝条附近不会产生气泡,故D错误;
故选B.
点评:本题考查原电池基础原理,难度不大,注意原电池两极判断与发生反应.

练习册系列答案
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案
相关题目
对于合成氨工业来说,下列叙述中正确的是( )
| A、使用催化剂和施加高压,都能提高反应速率,都对化学平衡状态无影响 |
| B、使用催化剂和施加高压,都能提高反应速率,只有压强对化学平衡状态有影响 |
| C、采用循环操作,能提高NH3的平衡浓度 |
| D、采用循环操作,能加快反应速率 |
用如图所示装置进行实验,装置正确且设计合理的是( )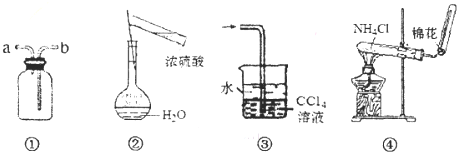

| A、装置①可用于排空气法收集NO气体 |
| B、可用图②所示装置及操作配制一定物质的量浓度的硫酸 |
| C、装置③可用于吸收氯化氢或氨气 |
| D、实验室可用装置④制取NH3 |