题目内容
20.几种短周期元素的原子半径及主要化合价见下表:| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | +2 | -2 |
| A. | M的原子半径比Q的大 | |
| B. | L、T形成的简单离子核外电子数相等 | |
| C. | R、L、M三种元素的金属性依次增强 | |
| D. | Q、T两元素的氢化物的稳定性为H nT>H nQ |
分析 短周期元素,Q、T均有-2价,处于ⅥA族,Q有+6价且原子半径Q>T,故Q为S元素、T为O元素;L、R均有+2价,处于ⅡA族,原子半径L>R,故L为Mg、R为Be;M有+3价,原子半径大于硫,故M为Al,据此解答.
解答 解:短周期元素,Q、T均有-2价,处于ⅥA族,Q有+6价且原子半径Q>T,故Q为S元素、T为O元素;L、R均有+2价,处于ⅡA族,原子半径L>R,故L为Mg、R为Be;M有+3价,原子半径大于硫,故M为Al.
A.M的原子半径为0.143nm,Q的原子半径为0.102nm,M的原子半径比Q的大,故A正确;
B.L、T形成的离子分别为Mg2+、O2-,离子核外电子数均为10,故B正确;
C.同周期自左而右金属性减弱,故Mg的金属性比Al的强,故C错误;
D.非金属性O>S,故氢化物的稳定性为H 2O>H 2O,故D正确.
故选:C.
点评 本题考查元素位置结构和性质的关系及应用,侧重对元素周期律的考查,题目难度中等,根据原子半径和元素化合价推断元素是解题关键.

练习册系列答案
相关题目
10.(1)元素周期表分为7个横行,即7个周期,周期表中有18个纵行,共16个族.
(2)写出下列物质的电子式:①CO2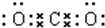 ;②NaOH
;②NaOH .
.
(3)下表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:
①在这些元素中最活泼的非金属元素是F.
②元素的最高价氧化物对应的水化物中酸性最强的是HClO4,碱性最强的是KOH.
③呈两性的氢氧化物是Al(OH)3,其与③的最高价氧化物水化物反应的离子方程式为Al(OH)3+OH-=AlO2-+H2O.
④在③~⑦元素中,原子半径最大的是Na.
(2)写出下列物质的电子式:①CO2
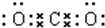 ;②NaOH
;②NaOH .
.(3)下表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
②元素的最高价氧化物对应的水化物中酸性最强的是HClO4,碱性最强的是KOH.
③呈两性的氢氧化物是Al(OH)3,其与③的最高价氧化物水化物反应的离子方程式为Al(OH)3+OH-=AlO2-+H2O.
④在③~⑦元素中,原子半径最大的是Na.
11.下列措施可以减缓盐酸与大理石反应速率的是( )
| A. | 升温 | B. | 改用粉末状大理石 | ||
| C. | 加入一定量水 | D. | 加入适量浓盐酸 |
8.下列仪器中一般不能用作反应容器的是( )
| A. |  | B. |  | C. |  | D. |  |
15.下列说法正确的是( )
| A. | 油脂、氨基酸、蛋白质都是人体重要的营养物质,它们都会水解 | |
| B. | 分子组成为CH4或C2H6O的有机物都不存在同分异构现象 | |
| C. | 欲将蛋白质从水中析出而又不改变它的性质,可加入CuSO4溶液 | |
| D. | 利用二氧化碳制造可降解塑料代替聚乙烯塑料,可减少“白色污染” |
1.下列说法不正确的是( )
| A. | 共价键一定存在于共价化合物中,也可能存在于离子化合物中 | |
| B. | Na2O2中既含有离子键也含有极性共价键 | |
| C. | NH4Cl是都由非金属元素组成的既含有离子键也含有共价键的离子化合物 | |
| D. | 熔化状态下不导电的化合物一定是共价化合物 |
2.既能与盐酸反应,又能与氢氧化钠溶液反应的化合物是( )
(1)氢氧化铝 (2)三氧化二铝 (3)铝 (4)碳酸氢钠 (5)氢氧化镁.
(1)氢氧化铝 (2)三氧化二铝 (3)铝 (4)碳酸氢钠 (5)氢氧化镁.
| A. | (1)(2)(3)(4) | B. | (1)(2)(3)(4)(5) | C. | (1)(2)(4) | D. | (1)(2)(4)(5) |


 $→_{光}^{氯气}$
$→_{光}^{氯气}$ $→_{△}^{氢氧化钠溶液}$
$→_{△}^{氢氧化钠溶液}$ $→_{催化剂}^{氧气}$
$→_{催化剂}^{氧气}$ .
. .
. .
.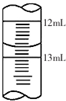 酱油是一种常用调味剂,根据国标要求酱油中NaCl的含量不应低于15g/100mL.莫尔法是较简单的一种测量Cl-含量的方法.现采用该法测量某市售酱油是否符合NaCl含量标准要求.实验原理如下(25℃):Ag++Cl-=AgCl (白色)Ksp(AgCl)=1.8×l0-10
酱油是一种常用调味剂,根据国标要求酱油中NaCl的含量不应低于15g/100mL.莫尔法是较简单的一种测量Cl-含量的方法.现采用该法测量某市售酱油是否符合NaCl含量标准要求.实验原理如下(25℃):Ag++Cl-=AgCl (白色)Ksp(AgCl)=1.8×l0-10