题目内容
14.如图所示的物质转化关系中,B、C、G为单质,C为黄绿色的气体,D为制光导纤维的原料,F为氧化物且常用作耐火材料.
请回答下列问题:
(1)A的电子式为
 ;G的化学式为H2.
;G的化学式为H2.(2)F与H的水溶液反应的离子方程式为MgO+2H+═Mg2++H2O.
(3)若B和D按物质的量之比4:1反应,该反应的化学方程式为SiO2+4Mg$\frac{\underline{\;\;△\;\;}}{\;}$Mg2Si+2MgO.
分析 B、C、G为单质,C为黄绿色的气体,则C为氯气,D为制光导纤维的原料,则D为二氧化硅,电解A得到B与氯气,B与二氧化硅反应得到E与F,而F为氧化物且常用作耐火材料,可推知A为氯化镁,B为Mg,F为氧化镁,(3)中若B(Mg)和D(二氧化硅)按物质的量之比4:1反应,由元素守恒可知D为Mg2Si,E为Si,H与F反应得到A与I,可知H为HCl,则G为氢气,I为水.
解答 解:B、C、G为单质,C为黄绿色的气体,则C为氯气,D为制光导纤维的原料,则D为二氧化硅,电解A得到B与氯气,B与二氧化硅反应得到E与F,而F为氧化物且常用作耐火材料,可推知A为氯化镁,B为Mg,F为氧化镁,(3)中若B(Mg)和D(二氧化硅)按物质的量之比4:1反应,由元素守恒可知D为Mg2Si,H与F反应得到A与I,可知H为HCl,则G为氢气,I为水.
(1)A为氯化镁,电子式为 ,G的化学式为H2,
,G的化学式为H2,
故答案为: ;H2;
;H2;
(2)F(MgO)与H(HCl)的水溶液反应的离子方程式为:MgO+2H+═Mg2++H2O,
故答案为:MgO+2H+═Mg2++H2O;
(3)若B(Mg)和D(二氧化硅)按物质的量之比4:1反应,该反应的化学方程式为:SiO2+4Mg$\frac{\underline{\;\;△\;\;}}{\;}$Mg2Si+2MgO,
故答案为:SiO2+4Mg$\frac{\underline{\;\;△\;\;}}{\;}$Mg2Si+2MgO.
点评 本题考查无机物推断,物质的颜色及用途是推断突破口,熟练掌握元素化合物知识,镁与二氧化硅的反应为难点,中学基本不涉及.

练习册系列答案
相关题目
5.设NA为阿伏加德罗常数的数值,下列叙述正确的是( )
| A. | 室温下,1 L pH=12的氨水溶液中含有0.01NA个NH4+ | |
| B. | 1molFeCl3与沸水反应生成胶体后,含有NA个Fe(OH)3胶粒 | |
| C. | 常温常压下,11.2L O2和O3的混合气体含有0.5NA个分子 | |
| D. | 78g Na2O2固体中含有离子总数必为3NA |
2.用于焊接钢轨的反应为Fe2O3+2Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe,该反应属于( )
| A. | 化合反应 | B. | 置换反应 | C. | 分解反应 | D. | 复分解反应 |
9.下列反应的离子方程式正确的是( )
| A. | 向Ba(OH)2溶液中滴加稀盐酸:Ba(OH)2+2H+═Ba2++2H2O | |
| B. | 碘化钠溶液和溴水反应:I-+Br2═I2+Br- | |
| C. | 碳酸钙溶于醋酸中:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| D. | 实验室用浓盐酸和MnO2制Cl2:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+Mn2++2H2O |
19.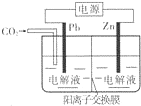 采用电化学法还原CO2是一种使CO2资源化的方法,下图是利用此法制备ZnC2O4的示意图(电解液不参与反应).下列说法正确的是( )
采用电化学法还原CO2是一种使CO2资源化的方法,下图是利用此法制备ZnC2O4的示意图(电解液不参与反应).下列说法正确的是( )
 采用电化学法还原CO2是一种使CO2资源化的方法,下图是利用此法制备ZnC2O4的示意图(电解液不参与反应).下列说法正确的是( )
采用电化学法还原CO2是一种使CO2资源化的方法,下图是利用此法制备ZnC2O4的示意图(电解液不参与反应).下列说法正确的是( )| A. | Zn与电源的负极相连 | |
| B. | ZnC2O4在交换膜右侧生成 | |
| C. | 电解的总反应为:2C02+Zn$\frac{\underline{\;电解\;}}{\;}$ZnC2O4 | |
| D. | 通入11.2 L CO2时,转移0.5 mol电子 |
3.下列指定反应的离子方程式正确的是( )
| A. | 用强碱溶液吸收硝酸工业的尾气:NO+NO2+2OH-═2NO2-+H2O | |
| B. | NH4HCO3溶液与足量NaOH溶液共热:NH4++HCO3-+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+NH3↑+2H2O | |
| C. | 明矾净水:Al3++3H2O═Al(OH)3↓+3H+ | |
| D. | 苯酚加入NaHCO3溶液中:C6H5OH+HCO3-→C6H5O-+CO2↑+H2O |