题目内容
16.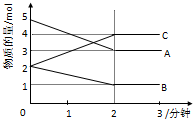 向某恒容的密闭容器中加入A、B、C三种气体,如图所示是一定条件下三种气体的物质的量随时间的变化情况.
向某恒容的密闭容器中加入A、B、C三种气体,如图所示是一定条件下三种气体的物质的量随时间的变化情况.(1)写出该密闭容器发生反应的化学方程式为2A+B?2C.
(2)反应开始至2分钟时,(能、不能)用C表示反应速率,若能,其反应速率为不能,若不能,则其原因为没体积无法求出C物质的浓度变化值.
(3)2分钟后A、B、C各物质的量不再随时间的变化而变化,其原因是正反应速率等于逆反应速率,反应处于平衡状态,即在该条件下反应达到最大限度.
(4)下列情况能说明该反应达到化学反应限度的是ab.
a.该容器的压强不在发生变化;
b.单位时间内生成A的物质的量与生成C的物质的量相同;
c.该容器中气体的密度不再改变;
d.容器中A的物质的量与C的物质的量相同.
分析 (1)根据物质的量的变化判断反应物和生成物,根据物质的量的变化之比等于化学计量数之比书写方程式;
(2)反应速率是单位时间内物质浓度的变化计算;
(3)反应达到平衡状态,各物质浓度不随时间变化;
(4)化学平衡的特征作判断,平衡的特征是正逆反应速率相同,各组分的含量保持不变;
解答 解::(1)由图象可以看出,反应中A、B的物质的量减小,C的物质的量增多,则A、B为反应物,C为生成物,
且△n(A):△n(B):△n(C)=2mol:1mol:2mol=2:1:2,则反应的化学方程式为:2A+B?2C,
故答案为:2A+B?2C;
(2)反应速率是单位时间内物质浓度的变化计算,反应体系的体积不知,不能计算物质浓度变化,不能计算反应速率,
故答案为:不能,没体积无法求出C物质的浓度变化值;
(3)2分钟后A、B、C各物质的量不再随时间的变化而变化,是因正反应速率等于逆反应速率,反应处于平衡状态,即在该条件下反应达到最大限度,
故答案为:正反应速率等于逆反应速率,反应处于平衡状态,即在该条件下反应达到最大限度;
(4)a、由于反应2A+B?2C是气体体积缩小的反应,反应从开始到达平衡状态时压强是不断减小的,如果压强不变则可以说明反应已经达到平衡状态,即反应达到化学反应限度,故a正确;
b、当单位时间内生成A的物质的量与生成C的物质的量相同时,逆反应速率等于正反应速率,所以反应达到平衡状态,故b正确;
c、由于该反应在恒容条件下进行,反应前后又都是气体,所以在反应时行过程中,体系的密度始终是不变的,所以密度不变不能作为平衡状态的判断标志,故c错误;
d、当容器中A的物质的量与C的物质的量相同时,不能判断正反应速率一定等于逆反应速率,所以不能作为化学平衡状态的判断标志,故d错误;
故答案为:ab.
点评 本题主要考查了平衡状态的判断标志,要求学生能准确理解化学平衡状态的特征,要从反应速率、组成成份、及其它物理量的变化特征来理解化学平衡的特征,题目难度不大.

 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案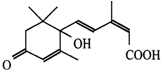 节日期间对大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开.S-诱抗素的分子结构如图,下列关于该物质的说法正确的是( )
节日期间对大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开.S-诱抗素的分子结构如图,下列关于该物质的说法正确的是( )| A. | 1mol该物质与足量金属钠完全反应产生2mol H2 | |
| B. | 该物质能与FeCl3溶液发生显色反应 | |
| C. | 1mol该物质最多与5 mol氢气加成 | |
| D. | 既能发生加聚反应,又能发生酯化反应 |
| A. | 芳香烃就是指苯和苯的同系物 | |
| B. | 通常可从煤焦油中或通过石油的催化重整来获取芳香烃 | |
| C. | 乙苯分子中所有原子可以处于同一平面上 | |
| D. | 苯和甲苯既能发生取代反应又能发生加成反应 |
 ,甲、乙、丙、丁四位同学分别将其命名为:2甲基4乙基1戊烯、2异丁基1丁烯、5甲基3己烯、4甲基2乙基1戊烯.下列对四位同学的命名判断正确的是( )
,甲、乙、丙、丁四位同学分别将其命名为:2甲基4乙基1戊烯、2异丁基1丁烯、5甲基3己烯、4甲基2乙基1戊烯.下列对四位同学的命名判断正确的是( )| A. | 甲的命名主链选择是错误的 | B. | 乙的命名正确 | ||
| C. | 丙的命名主链选择是正确的 | D. | 丁的命名正确 |
| A. | 电器着火,迅速用水灭 | |
| B. | 天然气泄漏,迅速开灯,查找泄漏点 | |
| C. | 图书着火,用干粉灭火器灭火 | |
| D. | 被围困在火灾区时,用湿毛巾捂住口鼻低下身子逃生 |
| A. | Na2O、Na2O2、CaO均属于碱性氧化物 | |
| B. | H2和HD属于同素异形体 | |
| C. | 蓝色的硫酸铜晶体遇到浓硫酸变白色属于化学变化 | |
| D. | 胶体带电,所以胶体具有电泳的性质 |