题目内容
8.甲烷是天然气的主要成分,是生产生活中应用非常广泛的一种化学物质.(1)一定条件下,用甲烷可以消除氮氧化物(NOx)的污染.已知:
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H1
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H2
现有一份在相同条件下对H2的相对密度为17的NO与NO2的混合气体,用16g甲烷气体催化还原该混合气体,恰好生成氮气、二氧化碳气体和水蒸气,共放出1042.8kJ热量.
①该混合气体中NO和NO2的物质的量之比为3:1.
②已知上述热化学方程式中△H1=-1160kJ/mol,则△H2=-1734 kJ/mol.
③在一定条件下NO气体可以分解为NO2气体和N2气体,写出该反应的热化学方程式:4NO(g)=2NO2(g)+N2(g)△H=-293kJ/mol.
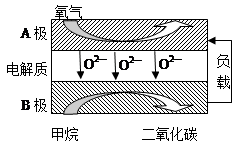
(2)以甲烷为燃料的新型电池,其成本大大低于以氢气为燃料的传统燃料电池,目前得到广泛地研究,如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图.回答下列问题:
④B极为电池负极,电极反应式为CH4-8e-+4O2-=CO2+2H2O.
⑤若用该燃料电池作电源,用石墨作电极电解100mL 1mol/L的硫酸铜溶液,当两极收集到的气体体积相等时理论上消耗的甲烷的体积为1.12L(标准状况下),实际上消耗的甲烷体积(折算到标准状况)比理论上大,可能原因为电池能量转化率达不到100%.
分析 (1)①相同条件下,不同气体的摩尔质量之比等于其密度之比,据此计算氮氧化物平均摩尔质量,再根据平均摩尔质量计算NO和二氧化氮的物质的量之比;
②根据盖斯定律确定甲烷和二氧化氮之间的方程式,根据甲烷和NO、NO2之间的反应确定分别和NO、NO2之间反应需要甲烷的物质的量之比,再根据焓变进行计算;
③根据盖斯定律书写热化学方程式;
(2)④B为负极,总反应式为CH4+2O2+=CO2+2H2O,正极反应式为:2O2+8e-=4O2-,两式相减可得负极电极反应式;
⑤开始阶段发生反应:2Cu2++2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+4H+,铜离子完全放电后,发生反应2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑,阳极的电极反应式是氢氧根离子放电,当两极收集到的气体体积相等时,即氢气与氧气的体积相等,令是氢气为xmol,根据电子转移守恒列方程计算,再根据电子转移守恒计算消耗的甲烷;根据电池中的能量转化率分析.
解答 解:(1)①在相同条件下对H2的相对密度为17的NO与NO2的混合气体,相同条件下,气体的密度之比等于其摩尔质量之比,所以混合气体的摩尔质量为34g/mol,设n(NO)为x,n(NO2)为y,
混合气体摩尔质量=$\frac{30xg+46yg}{(x+y)mol}$=34g/mol,x:y=3:1,
故答案为:3:1;
②16g甲烷的物质的量=$\frac{16g}{16g/mol}$=1mol,
根据盖斯定律知,CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H1
CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=0.5(△H1+△H2)
NO和NO2的物质的量之比为3:1,根据方程式知,当NO和NO2完全转化为氮气时,分别和NO、NO2反应的甲烷的物质的量之比=$\frac{3}{4}$:$\frac{1}{2}$=3:2,则有0.6mol甲烷和NO反应、0.4mol的甲烷和NO2反应,0.6mol甲烷和NO反应放出的热量=0.6mol×1160kJ/mol=696kJ,0.4mol甲烷和NO2完全反应放出的热量=1042.8kJ-696kJ=346.8kJ,则0.4mol甲烷和NO2完全反应放出的热量=0.5(△H1+△H2)×0.4mol=0.2mol×(1160kJ/mol+△H2)=346.8kJ,则△H2=$\frac{346.8kJ}{0.2mol}$=-1734 kJ/mol,
故答案为:-1734 kJ/mol;
③CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H1=-1160kJ/mol①
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574 kJ/mol②
根据盖斯定律,$\frac{①-②}{2}$得:4NO(g)=2NO2(g)+N2(g);△H=-293 kJ/mol;
故答案为:4NO(g)=2NO2(g)+N2(g)△H=-293 kJ/mol;
(2)④B为负极,总反应式为CH4+2O2+=CO2+2H2O,正极反应式为:2O2+8e-=4O2-,两式相减,负极反应为:CH4-8e-+4O2-=CO2+2H2O,
故答案为:负;CH4-8e-+4O2-=CO2+2H2O;
⑤硫酸铜的物质的量=0.1L×1mol/L=0.1mol,开始阶段发生反应:2Cu2++2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+4H+,铜离子完全放电后,发生反应2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑,阳极的电极反应式:4OH--4e-=O2↑+2H2O;当两极收集到的气体体积相等时,即氢气与氧气的体积相等,令是氢气为xmol,根据电子转移守恒,则:0.1mol×2+2x=4x,解得x=0.1,根据电子转移守恒,可知消耗的甲烷物质的量=$\frac{0.1mol×4}{8}$=0.05mol,故消耗甲烷的体积=0.05mol×22.4L/mol=1.12L,原电池中发生反应时化学能不去全部转化为电能,即电池能量转化率达不到100%,所以实际上消耗的甲烷的体积比理论上大;
故答案为:1.12L;电池能量转化率达不到100%.
点评 本题综合考查了反应热的计算、电化学知识等,题目整体计算量较大,侧重于对基础知识综合应用的考查,题目难度中等.

 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案反应试剂、产物的物理常数:
| 名称 | 相对分子质量 | 性状 | 熔点 | 沸点 | 密度 | 溶解度 | ||
| 水 | 乙醇 | 乙醚 | ||||||
| 甲苯 | 92 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8669 | 不溶 | ∞ | ∞ |
| 苯甲酸 | 122 | 白色片状或针状晶体 | 122.4 | 248 | 1.2659 | 微溶 | 易溶 | 易溶 |
实验方法:一定量的甲苯和KMnO4溶液置于图1装置中,在100℃时,反应一段时间,再停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯.
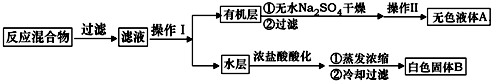
(1)仪器K的名称为安全瓶.无色液体A的结构简式为
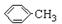 .操作Ⅱ为蒸馏.
.操作Ⅱ为蒸馏.(2)如果滤液呈紫色,要先加亚硫酸氢钾,然后再加入浓盐酸酸化,加亚硫酸氢钾的目的是除去未反应的高锰酸钾氧化剂,否则用盐酸酸化时会发生盐酸被高锰酸钾所氧化,产生氯气.
(3)下列关于仪器的组装或者使用正确的是ABD.
A.抽滤可以加快过滤速度,得到较干燥的沉淀
B.安装电动搅拌器时,搅拌棒下端不能与三颈烧瓶底、温度计等接触
C.抽滤结束后,为防止倒吸,应先关闭水龙头,再断开真空系统与过滤系统的连接
D.冷凝管中水的流向是下进上出
(4)除去残留在苯甲酸中的甲苯应先加入NaOH溶液,分液,水层再加入浓盐酸酸化,然后抽滤,干燥即可得到苯甲酸.
(5)纯度测定:称取1.220g产品,配成100ml溶液,取其中25.00ml溶液,进行滴定,消耗KOH物质的量为2.4×10-3mol.产品中苯甲酸质量分数为96%.
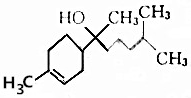
| A. | 分子式为C15H26O | B. | 能和NaHCO3溶液反应生成CO2 | ||
| C. | 不能使酸性高锰酸钾溶液褪色 | D. | 能与乙酸发生取代反应 |
| A. | 电解饱和食盐水时,当溶液pH由7变为13,电路中转移的电子数为0.1NA | |
| B. | 标准状况下,35.5 g 氯气与足量红热的铁充分反应得到的电子数一定为NA | |
| C. | 标准状况下,2.24 L HF中含有的原子数为0.2NA | |
| D. | 在密闭容器中加入0.5 moL N2和1.5 moL H2,充分反应后容器中的N-H键数为3NA |
(1)请指出该结论是否合理并说明理由不合理,Fe2+会被硝酸氧化为Fe3+,无法得知原催化剂中一定是否存在Fe3+.
(2)请完成对铁元素价态的探究:限选实验仪器与试剂:烧杯、试管、玻璃棒、药匙、滴管、酒精灯、试管夹;3mol•L-1H2SO4、3% H2O2、6mol•L-1HNO3、0.01mol•L-1KMnO4、NaOH稀溶液、0.1mol•L-1Kl、
20% KSCN、蒸馏水.
①提出合理假设
假设1:该催化剂中铁元素价态为+3;
假设2:该催化剂中铁元素价态为+2;
假设3:该催化剂中铁元素价态既有+2,也有+3.
②以下是某同学设计的实验验证方案,请将实验操作步骤、预期现象与结论补充完整.
| 实验操作 | 预期现象与结论 |
| 步骤1:将适量稀H2SO4加入少许样品于试管中,加热溶解; | 溶液呈黄绿色,说明溶液中可能含Fe2+和Fe3+. |
| 步骤2:取少量溶液,滴 加0.01mol/L的KMnO4溶液. | 若紫红色不褪去,则说明催化剂中含铁元素的价态+3价;若紫红色褪去, 则说明催化剂中含有铁元素的价态为+2价 |
| 步骤3:另取少量溶液,滴 加20%的KSCN溶液. | 若溶液变为血红色,则说明催化剂中含铁元素的价态+3价;若溶液无变化,则说明催化剂中含铁元素的价态+2价; |
| A. | Cl- | B. | Br- | C. | MnO4- | D. | H2S |


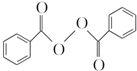 )过去常用作面粉增白剂,但目前已被禁用.合成过氧化苯甲酰的流程图如图:
)过去常用作面粉增白剂,但目前已被禁用.合成过氧化苯甲酰的流程图如图: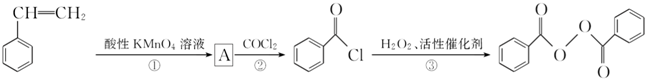
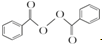 +2H2O→2
+2H2O→2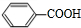 +H2O2;
+H2O2;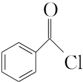 )能与水反应生成苯甲酸,同样也能与乙醇反应,写出其与乙醇反应生成的有机产物的名称苯甲酸乙酯;
)能与水反应生成苯甲酸,同样也能与乙醇反应,写出其与乙醇反应生成的有机产物的名称苯甲酸乙酯;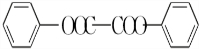 (或
(或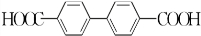 或
或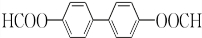 .;
.;