题目内容
14.对十二烷基苯磺酸钠 是常用洗涤剂的主要成分.其结构可用图形
是常用洗涤剂的主要成分.其结构可用图形 来表示,•端为链烃基,O端为极性基.根据这一结构特点,试分析和回答下列问题:
来表示,•端为链烃基,O端为极性基.根据这一结构特点,试分析和回答下列问题:Ⅰ.(1)十二烷基苯磺酸钠分子在其水溶液表面分布的结构示意图应是下列各图中的C图(填写序号),理由是水分子为极性分子,根据相似相溶原理,分子的极性基(O端)应溶解于水(亲水基),链烃基(•端)不应溶解于水(憎水基).

(2)进入介质(水)内部的十二烷基苯磺酸钠分子,可能会以下列结构形式中的AD存在(填写序号),理由是A中极性基交替排列,可减少分子之间的斥力;D中极性基(O端)向外、链烃基(•端)向内的排列,在一定程度上使憎水基团脱离与水的接触,使体系能量最低.

Ⅱ.工业合成对十二烷基苯磺酸钠的一种路线如图所示:

请回答下列问题:
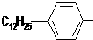
(3)产品中的亲油基是
 .
.(4)由十二烷基苯制取对十二烷基苯磺酸的化学方程式为
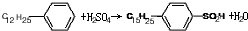 ,反应类型为取代反应.
,反应类型为取代反应.(5)在洗涤剂中添加酶制剂能促进污垢中的蛋白质(如奶渍、肉汤)等水解为可溶性的物质而被除去.使用加酶洗衣粉的水溶液中浸泡10~30min,水温在40~50℃最佳.加酶洗衣粉不宜在高温下、潮湿环境中贮存,也不宜久存.请解释原因酶发挥催化作用需要适宜的条件(温度、酸碱度等),酶自身是蛋白质在不适宜的条件(如高温、水解)下容易变质.
(6)过去使用的合成洗涤剂中常加入三聚磷酸钠(Na5P3O10)做助剂,它可使硬度大的洗涤水软化,对微细的无机粒子或油脂具有分散、乳化、胶溶作用,防止污渍再次沉积到衣物上;它还能维持水溶液的弱碱性,提高洗涤剂的去污能力和洗涤效果.但是,20世纪90年代以来,世界各国先后提出必须生产和使用无磷洗涤剂.请解释原因三聚磷酸钠造成水体富营养化,破坏了水体原有的生态平衡,对人类的生存环境造成了很大的影响.
分析 (1)分子的极性基(O端)应溶解于水(亲水基),链烃基(•端)不应溶解于水(憎水基);
(2)A中极性基交替排列,可减少分子之间的斥力;D中极性基(O端)向外、链烃基(•端)向内的排列,在一定程度上使憎水基团脱离与水的接触;
(3)烃基苯基是亲油基;
(4)十二烷基苯与硫酸反应生成对十二烷基苯磺酸;
(5)发挥催化作用需要适宜的条件,酶自身是蛋白质在不适宜的条件下容易变质;
(6)三聚磷酸钠造成水体富营养化,破坏了水体原有的生态平衡.
解答 解:(1)水分子为极性分子,分子的极性基(O端)应溶解于水(亲水基),链烃基(•端)不应溶解于水(憎水基),根据相似相溶原理,可知C正确,
故答案为:C;水分子为极性分子,根据相似相溶原理,分子的极性基(O端)应溶解于水(亲水基),链烃基(•端)不应溶解于水(憎水基);
(2)A中极性基交替排列,可减少分子之间的斥力;D中极性基(O端)向外、链烃基(•端)向内的排列,在一定程度上使憎水基团脱离与水的接触,使体系能量最低,则AD正确,
故答案为:AD; A中极性基交替排列,可减少分子之间的斥力;D中极性基(O端)向外、链烃基(•端)向内的排列,在一定程度上使憎水基团脱离与水的接触,使体系能量最低;
(3)烃基苯基是亲油基, 是亲油基,故答案为:
是亲油基,故答案为: ;
;
(4)十二烷基苯与硫酸反应生成对十二烷基苯磺酸,方程式: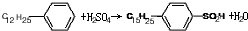 ,属于取代反应,
,属于取代反应,
故答案为: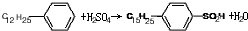 ;取代反应;
;取代反应;
(5)酶为蛋白质,具有蛋白质的性质,在高温下一发生变性而失去活性,所以使用加酶洗衣粉的水溶液中浸泡10~30min,水温在40~50℃最佳.加酶洗衣粉不宜在高温下、潮湿环境中贮存,也不宜久存,原因是酶发挥催化作用需要适宜的条件(温度、酸碱度等),酶自身是蛋白质在不适宜的条件下容易变质(如高温),
故答案为:酶发挥催化作用需要适宜的条件(温度、酸碱度等),酶自身是蛋白质在不适宜的条件(如高温、水解)下容易变质;
(6)磷为植物生长的营养元素,三聚磷酸钠造成水体富营养化,破坏了水体原有的生态平衡,对人类的生存环境造成了很大的影响,
故答案为:三聚磷酸钠造成水体富营养化,破坏了水体原有的生态平衡,对人类的生存环境造成了很大的影响.
点评 本题考查是对化学与技术的考查,为高频考点,侧重于学生的分析能力的考查,有利于培养学生良好的科学素养,题目涉及合成洗涤剂、油脂的性质、酶的性质、环境问题等,比较基础,理解合成洗涤剂中表面活性剂由亲油基团和亲水基团两部分构成,有利于基础知识的巩固.

| A | B | C | D |
 |  |  |  |
| NH3 | C2H2 | CCl4 | CO2 |
| A. | A、 | B. | B | C. | C | D. | D |
| A. | 1 L水中含有1 mol H2SO4 | |
| B. | 1 L溶液中含有1 mol H+ | |
| C. | 将98 g H2SO4溶于1 L水中配成溶液 | |
| D. | 1 L H2SO4溶液中含98 g H2SO4 |
| A. | CO32-、NO3- | B. | Na+、Cl- | C. | Na+、NO3- | D. | Cl-、Na+、NO3- |
| A. | 液溴保存过程中,应在其液面上加少量水进行液封 | |
| B. | 少量的碱金属单质均应保存在煤油中 | |
| C. | FeCl3溶液存放时应加少量盐酸 | |
| D. | AgNO3溶液和KMnO4溶液均应存放在棕色试剂瓶中 |
| A. | 加热蒸干Na2CO3溶液,最后可以得到NaOH和Na2CO3的混合固体 | |
| B. | 除去MgCl2中的Fe3+,可以加入NaOH固体 | |
| C. | 明矾净水的反应:Al3++3H2O?Al(OH)3(胶体)+3H+ | |
| D. | 加热蒸干KCl溶液,最后得到KOH固体(不考虑CO2的反应) |
| A. | SO2、SiO2、CO2均为酸性氧化物 | |
| B. | 稀豆浆、硅酸、氯化铁溶液均为胶体 | |
| C. | 烧碱、冰醋酸、四氯化碳、氨气均为电解质 | |
| D. | 福尔马林、水玻璃、氢氟酸、小苏打均为纯净物 |

 .
. .
. .
.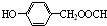 .
.