题目内容
7.已知:①标准状况下,1体积水中最多能溶解500体积的HCl;②饱和NaCl溶液的浓度约为5.00mol•L-1.将448L(标准状况下)HCl气体溶于1L水中,所得溶液A的密度为1.20g•cm-3,则溶液A中HCl的物质的量浓度为13.9mol/L.(本题计算结果均取三位有效数字)(1)若使1L饱和NaCl溶液中的Cl-浓度与溶液A中的Cl-浓度相等,则在1L饱和NaCl溶液中还应溶解199L标准状况下的HCl气体(溶液体积变化忽略不计).
(2)若将10.0mL溶液A稀释成500mL溶液B,则溶液B中HCl的物质的量浓度为0.278mol/L.
(3)在溶液B的配制过程中,使用前必须检查是否漏液的仪器是容量瓶.
分析 根据n=$\frac{V}{Vm}$计算HCl的物质的量,根据m=nM计算HCl的质量,从而计算出溶液的质量分数ω=$\frac{m(HCl)}{m(溶液)}$×100%,然后根据c=$\frac{1000ρω}{M}$计算溶液中HCl的物质的量浓度;
(1)饱和NaCl溶液的浓度约为5.00mol•L-1,根据两者的浓度差计算需溶解的氯化氢的量;
(2)若将10.0mL溶液A稀释成500mL溶液B,溶液体积增大50倍,则溶液B中HCl的物质的量浓度变为A中的$\frac{1}{50}$,据此分析计算;
(3)在配制一定物质的量浓度溶液的过程中,容量瓶一定要检查是否漏液.
解答 标况下448LHCl的物质的量n=$\frac{V}{Vm}$=$\frac{448L}{22.4L/mol}$=20mol,则HCl气体的质量m=nM=20mol×36.5g/mol=730g,故所得溶液的质量分数ω=$\frac{m(HCl)}{m(溶液)}$×100%=$\frac{730g}{730g+1000g}×100%$=42.2%,故溶液的物质的量浓度c=$\frac{1000ρω}{M}$=$\frac{1000×1.20×42.2%}{36.5}$=13.9mol/L.故答案为:13.9mol/L;
(1)饱和NaCl溶液的浓度约为5.00mol•L-1,需再溶解的氯化氢的量为(13.9-5)mol/L×22.4L/mol=199L,故答案为:199;
(2)若将10.0mL溶液A稀释成500mL溶液B,溶液体积增大50倍,则溶液B中HCl的物质的量浓度变为A中的$\frac{1}{50}$,即变为13.9mol/L×$\frac{1}{50}$=0.278mol/L,故答案为:0.278mol/L;
(3)在配制一定物质的量浓度溶液的过程中,容量瓶一定要检查是否漏液,其他的仪器不需要,故答案为:容量瓶.
点评 本题考查溶液的配制及有关物质的量浓度的计算,选择容量瓶的规格是解答本题的易错点,熟练应用物质的量浓度的相关计算公式等为解答的关键,侧重分析与计算能力的考查,题目难度中等.

| A. | 0.2摩/升 | B. | 0.4摩/升 | C. | 0.8摩/升 | D. | 1.6摩/升 |
| A. | 8种 | B. | 7种 | C. | 6种 | D. | 5种 |
| A. | 0.1 mol/L的KNO3 溶液500 ml | B. | 0.05mol/L的K2SO4 溶液300ml | ||
| C. | 0.04mol/L的K3PO4 溶液100 ml | D. | 0.06mol/L的KHCO3 溶液120 ml |
| A. | ①③ | B. | ②④ | C. | ①② | D. | ①③④ |
| A. | 用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗下口倒出 | |
| B. | 使用容量瓶的第一步操作是先将容量瓶用蒸馏水洗涤后烘干 | |
| C. | 用10 mL量筒量取9.2 mL NaCl溶液 | |
| D. | 检验某溶液是否含有SO42-时,应取少量该溶液,依次加入BaCl2溶液和稀盐酸 |
| 选项 | 被提纯的物质 | 杂质 | 除杂试剂 | 除杂方法 |
| A | Fe | Al | NaOH溶液 | 过滤 |
| B | 乙酸乙酯 | 乙醇 | 水 | 水洗、分液 |
| C | CO2 | SO2 | 饱和NaHCO3溶液、浓H2SO4 | 洗气 |
| D | NH4Cl(aq) | Cu2+(aq) | NaOH溶液 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
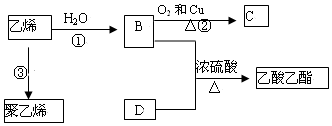
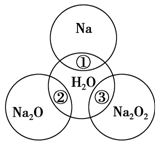 如图所示,两圆圈相交的部分表示圆圈内的物质相互发生的反应.已知钠及其氧化物的物质的量均为0.1mol,水的质量为100g,忽略溶液中溶剂的变化.完成下列题目.
如图所示,两圆圈相交的部分表示圆圈内的物质相互发生的反应.已知钠及其氧化物的物质的量均为0.1mol,水的质量为100g,忽略溶液中溶剂的变化.完成下列题目.