题目内容
1.下列说法正确的是( )| A. | 铜的金属活泼性比铁的弱,可在海轮外壳上镶入若干铜块以减缓海轮腐蚀 | |
| B. | 为处理锅炉水垢中的CaSO4,可先用饱和Na2CO3溶液浸泡,再加入盐酸溶解 | |
| C. | 实验室制氢气,为了加快反应速率,可向稀H2SO4中滴加少量Cu(NO3)2溶液 | |
| D. | 吸热反应TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g)在一定条件下可自发进行,则该反应的△S<0 |
分析 A.活泼金属铁为负极,加快腐蚀;
B.从难溶电解质的转化的角度分析;
C.硝酸根离子在酸性条件下具有强氧化性;
D.放热、熵增的反应有利于反应的自发进行.
解答 解:A.在海轮外壳上镶入若干铜块,活泼金属铁为负极,可以加快铁腐蚀,故A错误;
B.硫酸钙难以除去,可加入碳酸钠转化为碳酸钙,加入盐酸除去,故B正确;
C.加入硝酸铜,硝酸根离子在酸性条件下具有强氧化性,不生成氢气,故C错误;
D.根据反应自发进行的判据:△H-T△S<0时,化学反应能自发进行,当△H>0、△S<O时,判据一定大于零,反应非自发,故D错误.
故选B.
点评 本题考查电化学原理、难溶电解质的转化、化学反应与能量变化等综合知识,难度中等,选项C为解答的难点.

练习册系列答案
相关题目
11.下列反应的离子方程式正确的是( )
| A. | 碳酸氢镁溶液中加入足量的烧碱:HCO3-+OH-=CO32-+H2O | |
| B. | 铝粉投入到烧碱溶液中:Al+2OH-=AlO2-+H2↑ | |
| C. | 铁粉加到足量的稀硫酸中:2Fe+6H+=2Fe3++3H2↑ | |
| D. | 向FeSO4和KSCN溶液滴加酸化的H2O2溶液,立即变红:2Fe2++H2O2+2H+=2Fe3++2H2O,Fe3++3SCN-=Fe(SCN)3 |
9.pH=3和 PH=5的盐酸,等体积混合,混合后(假设体积不变)的PH为( )
| A. | 3 | B. | 3.1 | C. | 3.2 | D. | 3.3 |
16.下列实验可达到实验目的是( )
| A. | 可加入酸性KMnO4溶液鉴别苯、环己烯和己烷 | |
| B. | 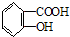 与适量NaOH溶液反应制备 与适量NaOH溶液反应制备 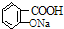 | |
| C. | 向卤代烃水解后的溶液中直接加入硝酸银溶液,可以确定卤代烃中的卤元素 | |
| D. | 利用盐析、过滤可将蛋白质和NaCl溶液分离 |
20.下列说法中正确的是( )
| A. | 同周期元素的原子电子层数相同 | |
| B. | (长式)元素周期表是按相对原子质量逐渐增大的顺序从左到右排列的 | |
| C. | 最外层电子数相同的元素都是同一族的元素 | |
| D. | 同一主族元素的原子最外层电子数一定相同 |
 ;N2的电子式
;N2的电子式 ;
; ,其中的化学键为离子键.
,其中的化学键为离子键.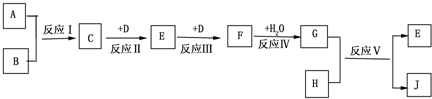


 +CH3CH2OH$\stackrel{H+}{→}$
+CH3CH2OH$\stackrel{H+}{→}$ +H2O,
+H2O, ;
; ,则H的结构简式是
,则H的结构简式是 .高聚物L由H通过肽键连接而成,写出生成L的方程式n
.高聚物L由H通过肽键连接而成,写出生成L的方程式n (或
(或 ),.
),.