题目内容
8.38.4g铜跟适量的浓硝酸反应,铜全部反应后,共收集到气体22.4L(标准状况),则反应消耗的HNO3的物质的量是( )| A. | 2.2mol | B. | 1mol | C. | 1.6mol | D. | 2mol |
分析 n(Cu)=$\frac{38.4g}{64g/mol}$=0.6mol,n(气体)=$\frac{22.4L}{22.4L/mol}$=1mol,由生成硝酸铜的物质的量可知表现酸性的硝酸的物质的量,由气体的物质的量可得被还原的硝酸的物质的量,以此计算反应消耗的硝酸的物质的量.
解答 解:铜的物质的量为:n(Cu)=$\frac{38.4g}{64g/mol}$=0.6mol,生成气体的物质的量为:n(气体)=$\frac{22.4L}{22.4L/mol}$=1mol,则被还原的硝酸的物质的量为1mol;
则生成n[Cu(NO3)2]的物质的量为0.6mol,可知表现酸性的硝酸的物质的量为0.6mol×2=1.2mol,
所以参加反应的硝酸的物质的量为:1mol+1.2mol=2.2mol,
故选A.
点评 本题考查了化学方程式的计算,题目难度中等,明确发生反应的实质为解答关键,注意掌握守恒思想中化学计算中的应用方法,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
19.元素周期律知识同族元素所形成的同一类型的化合物,其结构和性质都相似.化合物PH4I是一种白色晶体,下列对它的描述中不正确的是( )
| A. | 它是一种共价化合物 | |
| B. | 在加热时此化合物可以分解为PH3和HI或H2和I2 | |
| C. | 这种化合物能跟碱反应 | |
| D. | 该化合物可以由PH3和HI化合而成 |
3.下列说法中正确的是( )
| A. | 周期表中所有的族都是由长、短周期的元素共同组成 | |
| B. | 最外层电子数相同的元素不一定都是同一族 | |
| C. | 非金属元素都是主族元素,金属元素都是副族元素 | |
| D. | 元素周期表中共有18个纵行,每个纵行都是一个族,共有18个族 |
13.某有机物结构简式为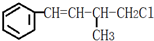 ,下列叙述错误的是( )
,下列叙述错误的是( )
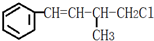 ,下列叙述错误的是( )
,下列叙述错误的是( )| A. | 1 mol 该有机物在加热和催化剂作用下,最多能和4 mol H2反应 | |
| B. | 该有机物能使溴水褪色,也能使酸性KMnO4溶液褪色 | |
| C. | 该有机物遇硝酸银溶液产生白色沉淀 | |
| D. | 该有机物在一定条件下能发生消去反应和取代反应 |
 ;
;
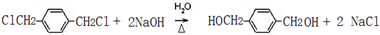 .
.