题目内容
5.不用其他任何试剂,只用试管和胶头滴管不能鉴别的是( )| A. | Al2(SO4)3与NaOH | B. | NaHSO4与Ba(OH)2 | C. | Na2CO3与HCl | D. | NaAlO2与H2SO4 |
分析 仅用用试管和胶头滴管,不用任何化学试剂就可以鉴别的物质可以采用相互滴加的方法检验,滴加顺序不同,现象不同的可以鉴别,反之现象相同,不能鉴别,以此来解答.
解答 解:A.NaOH和Al2(SO4)3滴加顺序不同,现象不同,将NaOH滴加到Al2(SO4)3中,先生成沉淀,后溶解,将Al2(SO4)3滴加到NaOH中,先没有现象,后生成沉淀,二者反应现象不同,可鉴别,故A不选;
B.NaHSO4与Ba(OH)2,无论滴加顺序如何,都生成BaSO4沉淀,不加其它试剂无法鉴别,故B选;
C.碳酸钠溶液和盐酸滴加顺序不同,现象不同,碳酸钠中滴加盐酸,先没有气体后生成气体,而盐酸钠中滴加碳酸钠,开始就生成气体,能鉴别,故C不选;
D.偏铝酸钠溶液和硫酸滴加顺序不同,现象不同,偏铝酸钠滴加到硫酸中先没有沉淀后生成沉淀,而硫酸滴定到偏铝酸钠溶液中先生成沉淀后消失,能鉴别,故D不选.
故选B.
点评 本题考查物质的检验和鉴别,题目难度中等,解答该类题目的关键是能把握相关物质的性质,学习中注意积累,注意滴加顺序不同发生的不同化学反应为解答关键.

练习册系列答案
相关题目
15.氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要应用.请回答下列问题.
(1)氮、磷、砷的电负性的大小关系是N>P>As,砷原子M层电子排布式为3s23p63d10.
(2)K3[Fe(CN)6]晶体中Fe3+与CN-之间的键型为配位键,该化学键能够形成的原因是
Fe3+提供空轨道,CN-提供孤电子形成配位键.
(3)已知:
分析上表中四种物质的相关数据,请回答:
①CH4和SiH4比较,沸点高低的原因是CH4和SiH4比较,影响熔沸点的因素是分子间作用力,SiH4之间的分子间作用力大,熔沸点高.
②NH3和PH3比较,分解温度高低的原因是NH3和PH3比较,影响分解温度的因素是共价键的强弱,N原子的半径比P原子的半径小,共价键的键长短,供价键强,分解温度高.
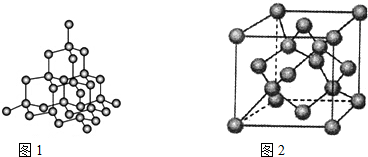
(4)金刚石是原子晶体,含有的最小环是六元环(如图2),每个碳原子连接12个六元环,如图1是金刚石的晶胞,若碳原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,碳原子在晶胞中的空间占有率$\frac{32π{r}^{3}}{3{a}^{3}}$×100%(不要求计算过程).
(1)氮、磷、砷的电负性的大小关系是N>P>As,砷原子M层电子排布式为3s23p63d10.
(2)K3[Fe(CN)6]晶体中Fe3+与CN-之间的键型为配位键,该化学键能够形成的原因是
Fe3+提供空轨道,CN-提供孤电子形成配位键.
(3)已知:
| CH4 | SiH4 | NH3 | PH3 | |
| 沸点(K) | 101.7 | 161.2 | 239.7 | 185.4 |
| 分解温度(K) | 873 | 773 | 1073 | 713.2 |
①CH4和SiH4比较,沸点高低的原因是CH4和SiH4比较,影响熔沸点的因素是分子间作用力,SiH4之间的分子间作用力大,熔沸点高.
②NH3和PH3比较,分解温度高低的原因是NH3和PH3比较,影响分解温度的因素是共价键的强弱,N原子的半径比P原子的半径小,共价键的键长短,供价键强,分解温度高.

(4)金刚石是原子晶体,含有的最小环是六元环(如图2),每个碳原子连接12个六元环,如图1是金刚石的晶胞,若碳原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,碳原子在晶胞中的空间占有率$\frac{32π{r}^{3}}{3{a}^{3}}$×100%(不要求计算过程).
16.室温下,水的电离达到平衡:H2O?H++OH-.下列叙述正确的是( )
| A. | 将水加热,平衡向正反应方向移动,Kw不变 | |
| B. | 向水中加入少量盐酸,平衡向逆反应方向移动,c(H+)增大 | |
| C. | 向水中加入少量NaOH固体,平衡向逆反应方向移动,c(OH-)降低 | |
| D. | 向水中加入少量Na2CO3固体,平衡向逆反应方向移动,c(OH-)>c(H+) |
13.需加入适当的氧化剂才能实现的反应是( )
| A. | Fe2O3→Fe3O4 | B. | Na2S4→Na2S2 | C. | S2O32-→S4O62- | D. | Cl3-→Cl- |
20.下列各组离子一定能大量共存的是( )
| A. | 能使酚酞试液变红的无色溶液中:Na+、CO32-、K+、ClO-、AlO2- | |
| B. | 能与金属铝反应放出氢气的溶液中:K+、SO42-、Cl-、NH4+ | |
| C. | 25℃时,某溶液中由水电离出的c(OH-)=1×10-13mol/L:NH4+、Fe3+、SO42-、Cl- | |
| D. | 含有HCO3-的溶液中:K+、OH-、NO3-、Ca2+ |
17.近段时间,我市经常被雾霾笼罩,雾霾天气的形成原因既有气象原因,也有污染排放原因.所以环境保护是我们当今面临的重大课题,下列污染现象主要与氮氧化合物无关的是( )
| A. | 臭氧空洞 | B. | 酸雨 | C. | 光化学烟雾 | D. | 温室效应 |
15.环己双妥明是一种新型的纤维酸类降脂新药,可由有机物X通过一步反应而制得:
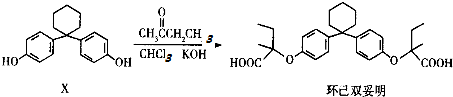
下列有关叙述正确的是( )

下列有关叙述正确的是( )
| A. | 有机物X的分子式为C18H22O2 | |
| B. | 有机物X与环己双妥明互为同系物 | |
| C. | 环己双妥明苯环上的一氯代物有4种 | |
| D. | 环己双妥明能与碳酸氢钠溶液发生反应 |