题目内容
(10分)下图是某化学兴趣小组设计的利用电子垃圾(含70%Cu、25%Al、4%Fe及少量Au、Pt)制备硫酸铜和硫酸铝晶体的路线:

已知下列信息:Cu可与稀硫酸和H2O2的混合液反应生成硫酸铜;铁、铝、铜等离子以氢氧化物形式沉淀时溶液的pH如下表:

请回答下列问题:
(1)写出Cu与稀硫酸和H2O2的混合液反应的化学方程式______________。
(2)在操作II中,x的取值范围是___________________。
(3)在操作III中,蒸发浓缩需要的玻璃仪器有______________________________________。
(4)由滤渣a制取Al2(SO4)3?18H2O,探究小组设计了三种方案:

综合考虑上述三种方案,最具可行性的是___________(填序号)。
(5)为测定CuSO4?5H2O晶体的纯度,进行下列实验:取a g 试样配成100mL溶液,每次取20.00mL,消除干扰离子后,用b mol/LEDTA(Na2H2Y)标准溶液滴定其中的Cu2+(离子方程式为Cu2++H2Y2-=CuY2-+2H+),滴定至终点,平均消耗EDTA溶液12.00mL,CuSO4?5H2O晶体的纯度是_________。
(1)Cu+H2O2+H2SO4=CuSO4+2H2O(2分) (2)[5.2,5.4) (2分)
(3)玻璃棒 酒精灯 (烧杯)(2分) (4)乙 (2分) (5)15b/a×100%(2分)
【解析】
试题分析:(1)双氧水具有氧化性,在稀硫酸溶液中将铜氧化为硫酸铜,方程式为Cu+H2O2+H2SO4=CuSO4+2H2O。
(2)依据图表数据分析可知,溶液pH调节为5.2~5.4,使Fe3+和Al3+形成沉淀,铜离子不沉淀。
(3)蒸发浓缩需要的玻璃仪器是玻璃棒、酒精灯(烧杯)。
(4)制备硫酸铝晶体的甲、乙、丙三种方法中,甲方案在滤渣中只加硫酸会生成硫酸铁和硫酸铝,冷却、结晶、过滤得到的硫酸铝晶体中混有大量硫酸铁杂质,方法不可行;乙方案先在滤渣中加H2SO4,生成Fe2(SO4)3和Al2(SO4)3,再加Al粉和Fe2(SO4)3生成Al2(SO4)3,蒸发、冷却、结晶、过滤可得硫酸铝晶体;丙方案先在滤渣中加NaOH和Al(OH)3反应生成NaAlO2,再在滤液中加H2SO4生成Al2(SO4)3,蒸发、冷却、结晶、过滤可得硫酸铝晶体;但从原子利用角度考虑方案乙更合理,因为丙加的NaOH和制备的Al2(SO4)3的原子组成没有关系,造成原子浪费;
(5)取a g试样配成100mL溶液,每次取20.00mL,消除干扰离子后,用b mol?L-1 EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液12mL.滴定反应如下:Cu2++H2Y2-=CuY2-+2H+。铜离子物质的量和标准液物质的量相同=bmol/L×0.012L=0.012bmol;依据元素守恒得到:则20ml溶液中含有的CuSO4?5H2O物质的量为0.012bmol;100ml溶液中含0.012bmol×5=0.06bmol;所以CuSO4?5H2O质量分数的表达式= ×100%=
×100%= ×100%。
×100%。
考点:考查离子分离的方法,实验设计,仪器和试剂选择,中和滴定的简单计算等

 2SO3为放热反应,对该反应的下列说法中正确的是
2SO3为放热反应,对该反应的下列说法中正确的是
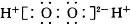 B. CS2的比例模型:
B. CS2的比例模型:
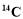 的原子结构示意图:
的原子结构示意图: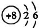 D. CCl4的结构式:
D. CCl4的结构式: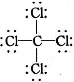

 2HI(g)△H=-9.48kJ/mol
2HI(g)△H=-9.48kJ/mol  6Cu+SO2↑,对于该反应,下列说法正确的是
6Cu+SO2↑,对于该反应,下列说法正确的是