题目内容
13.已知:Ksp[Fe(OH)3]=4.0×10-36.c(Fe3+)=4.0×10-3mol•L-1的溶液中,搅拌的同时向该溶液中滴加浓氨水,当开始出现氢氧化铁沉淀时,溶液的pH为( )| A. | 12 | B. | 11 | C. | 4 | D. | 3 |
分析 已知Ksp[Fe(OH)3]=4.0×10-36,结合难溶物溶度积的表达式及c(Fe3+)=4.0×10-3mol•L-1进行计算.
解答 解:溶液中c(Fe3+)=4.0×10-3mol•L-1,已知Ksp[Fe(OH)3]=4.0×10-36,当开始出现氢氧化铁沉淀时,c(OH-)=$\root{3}{\frac{4.0×1{0}^{-36}}{4.0×1{0}^{-3}}}$=1×10-11 mol/L,
此时溶液中氢离子浓度为c(H+)=$\frac{1×1{0}^{-14}}{1×1{0}^{-11}}$mol/L=1×10-3mol/L,该溶液的pH=-lg1×10-3 mol/L=3,
故选D.
点评 本题考查难溶电解质的计算,为高频考点,题目难度不大,把握Ksp与离子浓度的关系为解答的关键,侧重分析与计算能力的考查,培养了学生的灵活应用能力.

练习册系列答案
相关题目
8.一定条件想,将X和Y气体通入1L密闭容器中,发生反应:aX(g)+bY(g)?mZ(g),5s内反应速率如下:v(X)=0.3mol•L-1•s-1,v(Y)=0.6mol•L-1•s-1,v(Z)=0.6mol•L-1•s-1,则a、b、m的值分别为( )
| A. | 1、3、2 | B. | 1、2、2 | C. | 1、3、3 | D. | 1、1、3 |
9.在给定的条件下,下列选项所示的物质间转化均能实现的是( )
| A. | Al2O3$\stackrel{盐酸}{→}$AlCl3溶液$\stackrel{通电}{→}$Al | |
| B. | NH3$→_{△}^{O_{2}/催化剂}$NO2$\stackrel{H_{2}O}{→}$HNO3 | |
| C. | S$→_{点燃}^{O_{2}}$SO2$\stackrel{H_{2}O}{→}$H2SO4 | |
| D. | SiO2$\stackrel{NaOH溶液}{→}$Na2SiO3溶液$\stackrel{CO_{2}}{→}$H2SiO3 |
8.表是元素周期表的一部分,下列有关说法不正确的是( )
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 2 | a | b | |||||
| 3 | c | d | e | f |
| A. | 元素 a 是制备一种高效电池的重要材料 | |
| B. | 由于分子间氢键的作用,同族中由 b 元素形成的氢化物沸点是最高的 | |
| C. | c、d 两元素的单质构成原电池两电极时,d 可能为负极 | |
| D. | e、f 的含氧酸的酸性依次增强 |
18.下列实验“实验操作和现象”与“结论”都正确的是( )
| 选项 | 实验操作和现象 | 结论 |
| A | 分别测定饱和NaClO溶液与饱和CH3COONa溶液的pH,pH(NaC1O)>pH(CH3COONa) | ClO-结合H+的能力比 CH3COO- 的强 |
| B | 25℃时,向pH等于2的醋酸溶液中加入少量0.0lmol•L-1的稀盐酸,溶液的pH会变小 | 醋酸的电离程度增大 |
| C | 将稀硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色 | 氧化性:H2O2>Fe3+ |
| D | 向2mL2%NaOH溶液中加入lmLl%CuSO4溶液,振荡后滴加0.5mL5%葡萄糖溶液,加热至沸腾,出现红色沉淀 | 葡萄糖中含有醛基 |
| A. | A | B. | B | C. | C | D. | D |
5.下列说法正确的是( )
| A. | 铜的化学性质比铁稳定,在铁闸上安装铜块可减慢铁闸的腐蚀速率 | |
| B. | 氢氧燃料电池正极消耗5.6 L气体时,电路中通过的电子数为6.02×1023个 | |
| C. | 若2NO(g)+2CO(g)═N2(g)+2CO2(g)在常温下能自发进行,则该反应的△H<0 | |
| D. | 相同条件下,100 mL pH=3的HA溶液与HB溶液分别与足量的锌反应,HB放出氢气较多,说明HB酸性比HA的弱 |
3.下列实验说法正确的是( )
| A. | 向2mL10%的NaOH溶液中滴加2%CuSO4溶液4~6滴制得新制氢氧化铜悬浊液 | |
| B. | 将Al2(SO4)3溶液蒸干、灼烧至恒重,最终剩余固体是Al2O3 | |
| C. | 将水蒸气通过灼热的铁粉,铁粉变红棕色,说明铁与水在高温下能发生反应 | |
| D. | 取a克Na2CO3和NaHCO3混合物与少量稀盐酸充分反应,加热、蒸干、灼烧至熔化,冷却得b克固体,可测得Na2CO3质量分数 |
 .
. $→_{②}^{NaOH,乙醇,△}$
$→_{②}^{NaOH,乙醇,△}$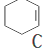 $→_{③}^{溴CCl_{4}溶液}$D$\stackrel{④}{→}$
$→_{③}^{溴CCl_{4}溶液}$D$\stackrel{④}{→}$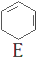
 ,名称是环己烷;
,名称是环己烷; ;B水解的化学方程式为
;B水解的化学方程式为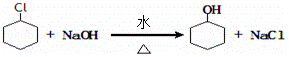 .
.