题目内容
13.化学在生产和生活中有重要的应用,下列说法不正确的是( )| A. | 可溶性铁盐、铝盐均可用于水的净化 | |
| B. | “开发利用新能源”、“汽车尾气催化净化”都能提高空气质量 | |
| C. | 电解NaCl溶液可制得金属钠 | |
| D. | 在海轮外壳上镶嵌上锌块,可减缓船体的腐蚀速率 |
分析 A.铁盐和铝盐水解出的氢氧化铁和氢氧化铝能沉淀杂质;
B.“开发利用新能源”“汽车尾气催化净化”可减少污染性气体的排放;
C.钠离子在溶液中不能放电;
D.原电池的正极被保护.
解答 解:A铁盐和铝盐水解出的氢氧化铁和氢氧化铝能沉淀杂质,故铁盐和铝盐可以净水.,故A正确;
B.“开发利用新能源”、“汽车尾气催化净化”可减少污染气体的排放,能提高空气质量,故B正确;
C.钠离子在溶液中不能放电,故制取金属钠需电解熔融的氯化钠,故C错误;
D.锌、铁和海水符合原电池构成条件,能形成原电池,可以减缓船体的腐蚀,故D正确.
故选C.
点评 本题考查常见生活环境污染、电解原理和原电池等,题目难度不大,注意提高空气质量的做法.

练习册系列答案
相关题目
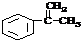
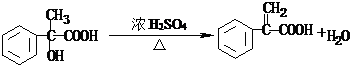
4.将 转变为
转变为 的方法为( )
的方法为( )
 转变为
转变为 的方法为( )
的方法为( )| A. | 与稀H2SO4共热后,加入足量的NaOH | |
| B. | 加入足量的稀盐酸共热 | |
| C. | 与稀H2SO4共热后,加入足量的NaHCO3 | |
| D. | 与足量的NaOH溶液共热后,再滴加过量的盐酸 |
1.已知:常温下,Ka(HF)>Ka(HClO).现有1L 0.1mol•L-1的两种溶液:①NaClO溶液;②NaF溶液.下列说法正确的是( )
| A. | c(H+):①>② | |
| B. | 分别加入1L 0.1mol•L-1HCl溶液后,两溶液的pH:①<② | |
| C. | 分别加入等浓度的盐酸至溶液呈中性,消耗盐酸的体积:①<② | |
| D. | n(HF)+n(F-)=n(HClO)+n(ClO-) |
8.碳及其化合物有广泛应用.
(1)工业冶炼铝,以石墨为阳极.阳极反应式为2O2--4e-=O2↑,可能发生副反应有C+O2$\frac{\underline{\;高温\;}}{\;}$CO2(或2C+O2$\frac{\underline{\;高温\;}}{\;}$2CO).
(2)一氧化碳和空气在酸性介质中构成燃料电池,负极反应式为.如果理论输出电压为1.50V,能量密度E=.
(3)向75mL 4mol•L-1KOH溶液中缓慢通入4480mL CO2气体(标准状况)恰好完全被吸收.①写出该反应的离子方程式:2CO2+3OH-=CO32-+HCO3-+H2O.
②该吸收溶液中离子浓度大小排序为c(K+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
③常温下,a mol•L-1KHCO3溶液的pH=8,HCO3-的水解常数约等于$\frac{10{\;}^{-12}}{a-10{\;}^{-6}}$.(用含a式表示).
(4)已知:①2H2(g)+O2(g)=2H2O(l)△H1=-571.6kJ•mol-1
②2CO(g)+O2(g)=2CO2(g)△H2=-566.0kJ•mol-1
③CO(g)+2H2(g)═CH3OH(g)△H3=-90.8kJ•mol-1
计算甲醇蒸气的燃烧热△H=-763.8kJ•mol-1.
(5)某温度下,发生可逆反应:CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41.0kJ•mol-1
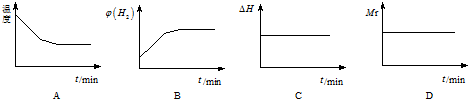
①向某容器中充入1.0molH2和1.0mol(g),在一定条件下发生上述反应.混合气体中CO的物质的量与时间关系如下列所示:
相对实验I,实验II可能改变的条件可能是,该温度下,平衡常数=1.
②若开始向绝热容器中投入一定量二氧化碳、氢气在一定条件下发生上述可逆反应.
下列图象正确且说明可逆反应达到平衡状态的是A.(填序号)
(1)工业冶炼铝,以石墨为阳极.阳极反应式为2O2--4e-=O2↑,可能发生副反应有C+O2$\frac{\underline{\;高温\;}}{\;}$CO2(或2C+O2$\frac{\underline{\;高温\;}}{\;}$2CO).
(2)一氧化碳和空气在酸性介质中构成燃料电池,负极反应式为.如果理论输出电压为1.50V,能量密度E=.
(3)向75mL 4mol•L-1KOH溶液中缓慢通入4480mL CO2气体(标准状况)恰好完全被吸收.①写出该反应的离子方程式:2CO2+3OH-=CO32-+HCO3-+H2O.
②该吸收溶液中离子浓度大小排序为c(K+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
③常温下,a mol•L-1KHCO3溶液的pH=8,HCO3-的水解常数约等于$\frac{10{\;}^{-12}}{a-10{\;}^{-6}}$.(用含a式表示).
(4)已知:①2H2(g)+O2(g)=2H2O(l)△H1=-571.6kJ•mol-1
②2CO(g)+O2(g)=2CO2(g)△H2=-566.0kJ•mol-1
③CO(g)+2H2(g)═CH3OH(g)△H3=-90.8kJ•mol-1
计算甲醇蒸气的燃烧热△H=-763.8kJ•mol-1.
(5)某温度下,发生可逆反应:CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41.0kJ•mol-1
①向某容器中充入1.0molH2和1.0mol(g),在一定条件下发生上述反应.混合气体中CO的物质的量与时间关系如下列所示:
| 0 | 5min | 10min | 15min | 20min | 25min | |
| I(800℃) | 1.0 | 0.80 | 0.70 | 0.65 | 0.50 | 0.50 |
| Ⅱ(800℃) | 1.0 | 0.7 | 0.60 | 0.50 | 0.50 | 0.50 |
②若开始向绝热容器中投入一定量二氧化碳、氢气在一定条件下发生上述可逆反应.
下列图象正确且说明可逆反应达到平衡状态的是A.(填序号)

18.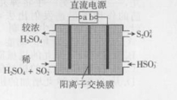 利用如图所示装置(电极均为惰性电极)可吸收SO2,并用阴极排出的溶液吸收NO2,下列叙述错误的是( )
利用如图所示装置(电极均为惰性电极)可吸收SO2,并用阴极排出的溶液吸收NO2,下列叙述错误的是( )
 利用如图所示装置(电极均为惰性电极)可吸收SO2,并用阴极排出的溶液吸收NO2,下列叙述错误的是( )
利用如图所示装置(电极均为惰性电极)可吸收SO2,并用阴极排出的溶液吸收NO2,下列叙述错误的是( )| A. | a为直流电源的正极 | |
| B. | 阴极的电极反应式为:2HSO3-+e-=S2O42-+H2O | |
| C. | 阳极的电极反应式为:SO2+2H2O-2e-=SO42-+4H+ | |
| D. | 电解时,H+由阳极室通过阳离子交换膜到达阴极室 |
2.关于如图所示装置(假设溶液体积不变),下列叙述正确的是( )
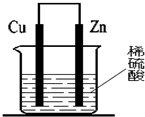

| A. | 电子从大量产生气泡的一极流出 | |
| B. | 反应一段时间后,溶液逐渐变为蓝色 | |
| C. | 逐渐溶解的一极上发生还原反应 | |
| D. | 烧杯内溶液中阳离子的物质的量浓度总和逐渐减小 |
3.下列离子方程式正确的是( )
| A. | 向FeI2溶液中通入等物质的量的Cl2:2I-+Cl2═2Cl-+I2 | |
| B. | 用过量氨水吸收烟道气中的SO2:SO2+NH3•H2O═HSO3-+NH4+ | |
| C. | 向NaHSO4溶液中加入Ba(OH)2至中性:H++SO42-+Ba2++OH-═H2O+BaSO4↓ | |
| D. | 向AgCl饱和溶液中滴加Na2S溶液:2AgCl+S2-═Ag2S+2Cl- |
 .
. .
. .
.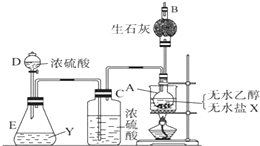 为证明乙醇分子中含有氧原子,现采用一套装置进行实验.试根据装置示意图、试剂及实验现象,回答有关问题.
为证明乙醇分子中含有氧原子,现采用一套装置进行实验.试根据装置示意图、试剂及实验现象,回答有关问题.