题目内容
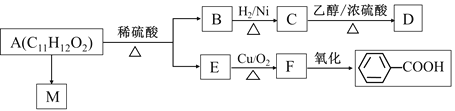
【题目】有机物M是有机合成的重要中间体,制备M的一种合成路线如下(部分反应条件和试剂已略去)
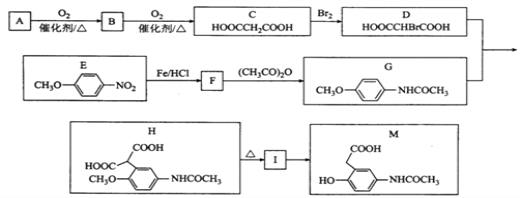
已知: ①A的密度是相同条件下H2密度的38倍;其分子的核磁共振氢谱中有3组峰;
②![]()
③![]()
请回答下列问题:
(1)B的化学名称为______________。A中官能团的电子式为________________。
(2)C中共面的原子最多有________个。I的结构简式为_____________________。
(3)F→G的化学方程式为________________________________________________。
(4)M不可能发生的反应为_______________(填选项字母)
A.加成反应 B.氧化反应 C.取代反应 D.消去反应
(5)同时满足下列条件的E的同分异构体有_________种。
①能与FeCl3溶液发生显色反应 ②能与NaHCO3反应 ③含有—个—NH2
(6)参照上述合成路线,以 ![]() 为原料(无机试剂任选),设计制备
为原料(无机试剂任选),设计制备![]() 的合成路线:_______________________________________________。
的合成路线:_______________________________________________。
【答案】 丙二醛 ![]() 9
9 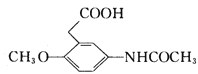
![]()
![]() D 10
D 10 ![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
【解析】A的密度是相同条件下H2密度的38倍,则A的相对分子质量为76,其分子的核磁共振氢谱中有3组峰,根据流程图,A属于醇类,且含有3个碳原子,则B为丙二醛,A为丙二醇。根据信息②,F为![]() ;结合H和M的结构和信息③,I为
;结合H和M的结构和信息③,I为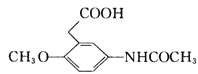 。
。
(1)B为丙二醛。A为丙二醇,其中官能团为羟基,电子式为![]() ,故答案为:丙二醛;
,故答案为:丙二醛;![]() ;
;
(2)C为丙二酸,羧基中的羰基是平面结构,C中共面的原子最多有9个。I为 ,故答案为:9;
,故答案为:9; ;
;
(3)F为![]() ,F→G的化学方程式为
,F→G的化学方程式为![]()
![]() ,故答案为:
,故答案为: ![]()
![]() ;
;
(4)M中含有羧基和羟基,可以发生取代反应,羟基能够被氧化,含有肽键,能够发生水解反应,含有苯环,能够发生与氢气的加成反应,不能发生消去反应,故选D;
(5)E为![]() 。①能与FeCl3溶液发生显色反应,说明含有酚羟基,②能与NaHCO3反应,说明含有羧基,③含有—个—NH2,说明苯环上含有1个羧基、1个羟基和1个氨基,同时满足条件的E的同分异构体有:当氨基和羧基位于邻位时,羟基有4种位置,即4种同分异构体;当氨基和羧基位于间位时,羟基有4种位置,即4种同分异构体;当氨基和羧基位于对位时,羟基有2种位置,即2种同分异构体;共10种,故答案为:10;
。①能与FeCl3溶液发生显色反应,说明含有酚羟基,②能与NaHCO3反应,说明含有羧基,③含有—个—NH2,说明苯环上含有1个羧基、1个羟基和1个氨基,同时满足条件的E的同分异构体有:当氨基和羧基位于邻位时,羟基有4种位置,即4种同分异构体;当氨基和羧基位于间位时,羟基有4种位置,即4种同分异构体;当氨基和羧基位于对位时,羟基有2种位置,即2种同分异构体;共10种,故答案为:10;
(6)以 ![]() 为原料制备
为原料制备![]() ,可以首先制得
,可以首先制得 ![]() ,再由
,再由![]() 发生缩聚反应即可。由
发生缩聚反应即可。由![]() 制
制![]() ,需要将溴原子水解为羟基,再氧化就可以得到羧基,将硝基还原就可以得到氨基,因此合成路线为:
,需要将溴原子水解为羟基,再氧化就可以得到羧基,将硝基还原就可以得到氨基,因此合成路线为:![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() ,故答案为:
,故答案为:![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() 。
。

 名校课堂系列答案
名校课堂系列答案【题目】碳和氮的化合物在生产生活中广泛存在。回答下列问题:![]() 三氯化氮
三氯化氮![]() 是一种黄色、油状、具有刺激性气味的挥发性有毒液体,各原子均满足8电子稳定结构。其电子式是______。氯碱工业生产时,由于食盐水中通常含有少量
是一种黄色、油状、具有刺激性气味的挥发性有毒液体,各原子均满足8电子稳定结构。其电子式是______。氯碱工业生产时,由于食盐水中通常含有少量![]() ,而在阴极区与生成的氯气反应产生少量
,而在阴极区与生成的氯气反应产生少量![]() ,该反应的化学方程式为______。
,该反应的化学方程式为______。![]() 一定条件下,不同物质的量的
一定条件下,不同物质的量的![]() 与不同体积的
与不同体积的![]() 溶液充分反应放出的热量如下表所示:
溶液充分反应放出的热量如下表所示:
反应序号 | n | V | 放出的热量 |
1 |
|
| A |
2 |
|
| b |
该条件![]() 与NaOH 溶液反应生成
与NaOH 溶液反应生成![]() 的热化学反应方程式为______。
的热化学反应方程式为______。![]() 利用CO可以将NO转化为无害的
利用CO可以将NO转化为无害的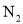 ,其反应为:
,其反应为:![]() ,向容积均为1L的甲,乙两个恒温
,向容积均为1L的甲,乙两个恒温![]() 温度分别为
温度分别为![]() 、
、![]() 容器中分别加入
容器中分别加入![]() 和
和![]() ,测得各容器中
,测得各容器中![]() 随反应时间t的变化情况如下表所示:
随反应时间t的变化情况如下表所示:
| 0 | 40 | 80 | 120 | 160 |
|
|
|
|
|
|
|
|
|
|
|
|
![]() 甲容器中,
甲容器中,![]() 内用NO的浓度变化表示的反应速率
内用NO的浓度变化表示的反应速率![]() ______。
______。![]() 该反应的
该反应的![]() ______
______![]() 填“
填“![]() ”或“
”或“![]() ”
”![]() 。
。![]() 甲容器反应达到平衡后,若容器内各物质的量均增加1倍,则平衡______
甲容器反应达到平衡后,若容器内各物质的量均增加1倍,则平衡______![]() 填“正向”、“逆向”或“不”
填“正向”、“逆向”或“不”![]() 移动。
移动。![]() 常温下,在
常温下,在![]() 溶液中,反应
溶液中,反应![]() 的平衡常数
的平衡常数![]() ______。
______。![]() 已知常温下,
已知常温下,![]() 的电离平衡常数
的电离平衡常数![]() ,
,![]() 的电离平衡常数
的电离平衡常数![]() ,
,![]()
![]() 在酸性电解质溶液中,以惰性材料作电极,将
在酸性电解质溶液中,以惰性材料作电极,将![]() 转化为丙烯的原理如图所示
转化为丙烯的原理如图所示
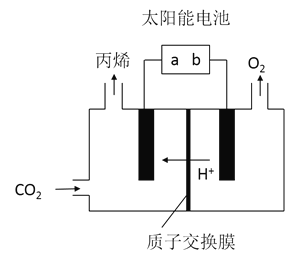
![]() 太阳能电池的负极是______
太阳能电池的负极是______![]() 填“a”或“b”
填“a”或“b”![]()
![]() 生成丙烯的电极反应式是______。
生成丙烯的电极反应式是______。
【题目】用试纸检验气体性质是一种重要的实验方法.如表所示的实验中![]() 可加热
可加热![]() ,下列试纸的选用、现象、对应结论都正确的一项是
,下列试纸的选用、现象、对应结论都正确的一项是![]()
序号 | 试剂B | 湿润的试纸A | 结论 |
A | 碘水 | 淀粉试纸变蓝 | 碘具有氧化性 |
B | 浓氨水、生石灰 | 蓝色石蕊试纸变红 | 氨气为碱性气体 |
C |
| 品红试纸褪色 |
|
D | Cu、浓硝酸 | 淀粉KI试纸变蓝 |
|
A.AB.BC.CD.D