题目内容
7.下列有关元素周期表的说法中正确的是( )| A. | 元素周期表有18个族 | |
| B. | 第IA族元素称为碱金属元素 | |
| C. | 原子最外层电子数相同的元素,一定属于同一族 | |
| D. | 第3列至第12列的元素全为金属元素 |
分析 A.元素周期表含有7个主族、7个副族、1个零族、1个第Ⅷ族;
B.IA族包含碱金属与氢元素;
C.He、Mg最外层电子数都为2;
D.第3列至第12列为副族和第ⅤⅢ族.
解答 解:A.元素周期表共有18个纵行,但含有7个主族、7个副族、1个零族、1个第Ⅷ族,共有16个族,故A错误;
B.IA族包含碱金属与氢元素,除氢之外的其它元素属于碱金属,故B错误;
C.He、Mg最外层电子数都为2,不属于同一族,故C错误;
D.第3列至第12列为过渡金属元素,故D正确.
故选D.
点评 本题考查元素周期表的结构,为高频考点,比较基础,旨在考查学生对基础知识的掌握、有利于培养学生良好的科学素养.

练习册系列答案
相关题目
17.下列说法不正确的是( )
| A. | ⅠA元素的电负性从上到下逐渐减小,ⅦA元素的第一电离能从上到下逐渐减小 | |
| B. | 电负性的大小可以作为衡量元素的金属性和非金属性强弱的尺度 | |
| C. | 氢原子中只有一个电子,故氢原子只有一个原子轨道 | |
| D. | NaH的存在能支持可将氢元素放在ⅦA的观点 |
15.设NA为阿伏加德罗常数的值,下列有关叙述不正确的是( )
| A. | 26g C2H2和苯蒸气的混合气体中所含的C原子数为2NA | |
| B. | 1mol甲基(-CH3)所含电子数为9NA | |
| C. | 标准状况下,B2H6和C2H4的混合气体22.4L,所含的电子数约为16NA | |
| D. | 标准状况下,1L庚烷所含有的分子数为NA/22.4 |
2.下列说法中正确的是( )
| A. | PCl3分子是三角锥形,这是因为磷原子是sp2杂化的结果 | |
| B. | 乙烯分子中的碳氢键是氢原子的1s轨道和碳原子的一个个sp3杂化轨道形成的 | |
| C. | 中心原子采取sp3杂化的分子,其几何构型可能是四面体形或三角锥形或V形 | |
| D. | AB3型的分子空间构型必为平面三角形 |
12.下列各项不属于官能团的是( )
| A. | NO3- | B. | -NO2 | C. | -OH | D. | 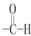 |
16.YBa2Cu8Ox(Y为钇元素)是磁悬浮列车中的重要超导材料,关于${\;}_{39}^{89}$Y的说法正确的是( )
| A. | 钇在周期表中的位置是第4周期ⅢB族 | |
| B. | 属于非金属元素 | |
| C. | ${\;}_{39}^{89}$Y和${\;}_{39}^{90}$Y是两种不同的核素 | |
| D. | 中子数为39 |
17.将1.92g铜粉与一定浓度的硝酸反应,随着反应的进行,气体颜色逐渐变浅,当铜粉完全作用时收集到气体0.05mol.则所消耗的硝酸的物质的量是( )
| A. | 0.12 mol | B. | 0.11 mol | C. | 0.09 mol | D. | 0.08 mol |
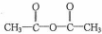 .
.
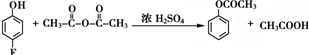 ;反应⑤的化学方程式为
;反应⑤的化学方程式为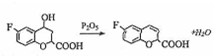 .
.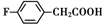 、
、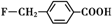 .
. 和乙酸酐为原料制备
和乙酸酐为原料制备 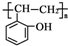 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:
的合成路线流程图(无机试剂任选).合成路线流程图示例如下: 2015年3月,全国“两会”代表委员就我国“雾霾”治理积极建言献策.科学家研究表明氮氧化物与悬浮在大气中的盐粒子相互作用时能产生“二次雾霾”,涉及的反应有:
2015年3月,全国“两会”代表委员就我国“雾霾”治理积极建言献策.科学家研究表明氮氧化物与悬浮在大气中的盐粒子相互作用时能产生“二次雾霾”,涉及的反应有: