题目内容
6.已知温度为T时:CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=+165kJ•mol-1CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41kJ•mol-1
贮氢合金ThNi5可催化由CO、H2合成CH4的反应.温度为T时,该反应的热化学方程式为CO(g)+3H2(g)═CH4(g)+H2O(g)△H=-206kJ/mol.
分析 ①CH4(g)+2H2O═CO2(g)+4H2(g)△H=+165kJ•mol-1
②CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41kJ•mol-1,
由盖斯定律可知,②-①得到CO(g)+3H2(g)═CH4(g)+H2O(g),以此来解答.
解答 解:①CH4(g)+2H2O═CO2(g)+4H2(g)△H=+165kJ•mol-1
②CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41kJ•mol-1,由盖斯定律可知,②-①得到CO(g)+3H2(g)═CH4(g)+H2O(g),△H=-41kJ•mol-1-(+165kJ•mol-1)=-206kJ/mol,
则热化学方程式为:CO(g)+3H2(g)═CH4(g)+H2O(g)△H=-206kJ/mol,
故答案为:CO(g)+3H2(g)═CH4(g)+H2O(g)△H=-206kJ/mol.
点评 本题考查了盖斯定律在热化学方程式计算中的应用,题目难度中等,明确盖斯定律的内容为解答关键,注意掌握热化学方程式的书写原则.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
7.下列对相应有机物的描述完全正确的是( )
①甲烷:天然气的主要成分,能发生取代反应
②乙烯:其产量是衡量一个国家石油化工发展水平的标志,可以发生加成反应
③苯:平面结构,每个分子中含有3个碳碳双键
④乙醇:可以用金属钠检验乙醇中是否含有水
⑤淀粉:属于糖类物质,遇碘元素变蓝色
⑥蛋白质:可通过烧焦的特殊气味进行鉴别,水解的最终产物为氨基酸.
①甲烷:天然气的主要成分,能发生取代反应
②乙烯:其产量是衡量一个国家石油化工发展水平的标志,可以发生加成反应
③苯:平面结构,每个分子中含有3个碳碳双键
④乙醇:可以用金属钠检验乙醇中是否含有水
⑤淀粉:属于糖类物质,遇碘元素变蓝色
⑥蛋白质:可通过烧焦的特殊气味进行鉴别,水解的最终产物为氨基酸.
| A. | ①②③ | B. | ②④⑥ | C. | ①⑤⑥ | D. | ①②⑥ |
11.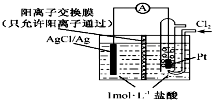 某原电池装置如右图所示,电池总反应为2Ag+Cl2═2AgCl.已知:阳离子交换膜只允许阳离子通过,阴离子不能通过,离子交换过程中溶液电荷守恒.下列说法正确的是( )
某原电池装置如右图所示,电池总反应为2Ag+Cl2═2AgCl.已知:阳离子交换膜只允许阳离子通过,阴离子不能通过,离子交换过程中溶液电荷守恒.下列说法正确的是( )
 某原电池装置如右图所示,电池总反应为2Ag+Cl2═2AgCl.已知:阳离子交换膜只允许阳离子通过,阴离子不能通过,离子交换过程中溶液电荷守恒.下列说法正确的是( )
某原电池装置如右图所示,电池总反应为2Ag+Cl2═2AgCl.已知:阳离子交换膜只允许阳离子通过,阴离子不能通过,离子交换过程中溶液电荷守恒.下列说法正确的是( )| A. | 正极反应为AgCl+e-=Ag+Cl- | |
| B. | 电池工作时,交换膜右侧溶液中有大量白色沉淀生成 | |
| C. | 若用KCl溶液代替盐酸,则电池总反应随之改变 | |
| D. | 当电路中转移0.2 mol e-时,交换膜左侧溶液中约减少0.4 mol离子 |
18.下列说法正确的是( )
| A. | H2、D2、T2互为同素异形体 | |
| B. | 液氨、氨水、王水都是混合物 | |
| C. | H2O、苯酚、Fe(SCN)3都是弱电解质 | |
| D. | 硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物 |
15.用标准盐酸溶液滴定未知浓度的氢氧化钠溶液,使得所测氢氧化钠溶液的浓度偏高的错误操作是( )
| A. | 中和滴定达中点时俯视滴定管内液面度数 | |
| B. | 碱式滴定管用蒸馏水洗净后立即装待测溶液来滴定 | |
| C. | 酸式滴定管用蒸馏水洗净后立即装标准溶液来滴定 | |
| D. | 把配好的标准溶液倒入刚用蒸馏水洗净的锥形瓶中然后用来滴定 |
16.mmol C2H4跟 nmol H2在密闭容器中反应,生成pmol C2H6.将反应后的混合气体完全燃烧,生成CO2和H2O,所需氧气的物质的量是( )
| A. | 3.5 pmol | B. | (3m+$\frac{n}{2}$-3p)mol | C. | (3m+$\frac{n}{2}$)mol | D. | (3m+n)mol |
 50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在下图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.
50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在下图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.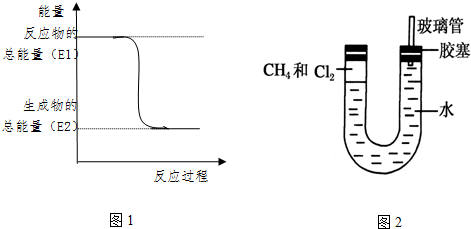
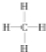 .一定量的该气体燃烧过程的能量变化如图1所示,从图中可以读出E1>E2(填“>”或“<”),该反应放出 (填“放出”或“吸收”)能量.
.一定量的该气体燃烧过程的能量变化如图1所示,从图中可以读出E1>E2(填“>”或“<”),该反应放出 (填“放出”或“吸收”)能量.