题目内容
 往一体积不变的密闭容器中充入H2和I2,发生反应H2(g)+I2(g)?2HI(g);△H<0,当达到平衡后,t0时若保持混合气体总物质的量不变而改变某一反应条件,使容器内压强增大(如图所示),下列说法正确的是.( )
往一体积不变的密闭容器中充入H2和I2,发生反应H2(g)+I2(g)?2HI(g);△H<0,当达到平衡后,t0时若保持混合气体总物质的量不变而改变某一反应条件,使容器内压强增大(如图所示),下列说法正确的是.( )| A、容器内气体颜色变深,平均相对分子质量不变 |
| B、平衡不移动,混合气体密度增大 |
| C、H2转化率增大,HI平衡浓度减小 |
| D、t0时减小体积或升高体系温度 |
考点:化学平衡的影响因素
专题:化学平衡专题
分析:t0时改变反应的某一条件,正逆反应速率都增大,且逆反应速率大于正反应速率,则平衡向逆反应方向移动,该反应前后气体计量数不变,则只能是通过升高温度来实现,据此分析解答.
解答:
解:t0时改变反应的某一条件,正逆反应速率都增大,且逆反应速率大于正反应速率,则平衡向逆反应方向移动,该反应前后气体计量数不变,则只能是通过升高温度来实现,
A.平衡向逆反应方向移动,碘的物质的量增大,则容器内气体颜色变深,混合气体的物质的量和质量都不变,所以平均相对分子质量不变,故A正确;
B.t0时改变反应的某一条件瞬间,正逆反应速率不相等,则平衡发生移动,因为容器的体积不变、混合气体的质量不变,则密度不变,故B错误;
C.平衡向逆反应方向移动,H2转化率减小,HI平衡浓度变小,故C错误;
D.通过以上分析知,t0时改变的条件是升高温度,减少体积压强增大,平衡不动不符合,故D错误;
故选A.
A.平衡向逆反应方向移动,碘的物质的量增大,则容器内气体颜色变深,混合气体的物质的量和质量都不变,所以平均相对分子质量不变,故A正确;
B.t0时改变反应的某一条件瞬间,正逆反应速率不相等,则平衡发生移动,因为容器的体积不变、混合气体的质量不变,则密度不变,故B错误;
C.平衡向逆反应方向移动,H2转化率减小,HI平衡浓度变小,故C错误;
D.通过以上分析知,t0时改变的条件是升高温度,减少体积压强增大,平衡不动不符合,故D错误;
故选A.
点评:本题考查化学反应速率与化学平衡的影响因素、化学平衡图象等,把握pV=nRT判断改变的条件为升高温度是解题的关键,明确温度对平衡移动的影响即可解答,题目难度中等.

练习册系列答案
相关题目
某有机物在氧气中充分燃烧,生成的水蒸气、二氧化碳的物质的量之比为1:1,由此可得出的结论是( )
| A、该有机物分子中C、H、O原子个数比为1:2:3 |
| B、分子中碳、氢原子个数比为1:2 |
| C、有机物中必定含有氧元素 |
| D、有机物中肯定不含有氧元素 |
向一定量下列物质的溶液中逐滴加入氢氧化钠溶液,先生成白色沉淀,后沉淀逐渐溶解.这种物质是( )
| A、硫酸镁 | B、偏铝酸钠 |
| C、氯化铝 | D、氯化铁 |
在氯化铁溶液中加入过量的铁粉,充分反应后,下列结论错误的是( )
| A、溶液的质量将增大 |
| B、溶质的物质的量浓度增大 |
| C、溶液中的金属离子全部是Fe2+ |
| D、溶液中的金属离子既有Fe3+,又有Fe2+ |
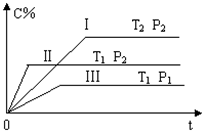 在一固定容积的密闭容器中充入气体A和B,发生如下可逆反应:
在一固定容积的密闭容器中充入气体A和B,发生如下可逆反应:A(g)+B(g)?xC(g)△H=Q.在不同的温度和压强下,C在反应混合物中的含量随反应时间的变化如图所示.下列判断正确的是( )
| A、T1>T2,Q<0 |
| B、T1<T2,Q>0 |
| C、P1>P2,x=1 |
| D、P1<P2,x≠1 |
常温下,将pH=1的H2SO4溶液平均分成两等份,一份加入适量水,另一份加入与该H2SO4溶液物质的量浓度相同的NaOH溶液,两者pH都升高了1,则加入的水和NaOH溶液的体积比为(假设混合前后溶液体积不变)( )
| A、5:1 | B、6:1 |
| C、10:1 | D、11:1 |
可用于区别苯酚、乙醇、氢氧化钠、硝酸银、硫氰化钾五种溶液的试剂是( )
| A、浓溴水 |
| B、石蕊试剂 |
| C、FeCl3溶液 |
| D、KMnO4溶液 |
