题目内容
8.Fe3+的电子排布式是1s22s22p63s23p5或[Ar]3p5.分析 据元素符号,判断微粒的核外电子数,再根据核外电子排布规律来写.
解答 解:铁原子失去最外层4s能级2个电子,然后失去3d能级上的1个电子形成Fe3+,核外电子排布式为:1s22s22p63s23p63d5;
故答案为:1s22s22p63s23p63d5.
点评 本题考查了铁的位置性质,原子结构,掌握核外电子排布规律是关键,题目较简单.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
18.几种短周期元素的原子半径及主要化合价如表:
下列叙述正确的是( )
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +2 | -2 |
| A. | R的氧化物对应的水化物可能具有两性 | |
| B. | L、M的单质与稀硫酸反应速率:M>L | |
| C. | T、Q的氢化物常态下均为无色气体 | |
| D. | L、Q形成的简单离子核外电子数相等 |
19.工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、SO2等气体,严重污染空气.对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用.
Ⅰ.脱硝:催化剂存在下,H2还原NO2生成水蒸气和其它无毒物质的化学方程式为4H2+2NO2$\frac{\underline{\;催化剂\;}}{\;}$N2+4H2O.
Ⅱ.脱碳:向2L密闭容器中加入2mol CO2、6mol H2,在恒温恒容的条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0
(1)下列叙述能说明此反应达到平衡状态的是bce.
a.单位时间内生成n mol CH3OH的同时生成n mol H2O
b.CO2和H2的物质的量分数保持不变
c.CO2和H2的浓度保持不变
d.混合气体的密度保持不变
e.生成1mol CO2生成的同时有3mol H-H键断裂
(2)该反应过程中部分数据见下表:
①20min时,反应是否达到平衡状态?是(填“是”或“否”).
简述理由:20min时,n(CH3OH)为1mol,与30min时相同.
②前10min内的平均反应速率v(CH3OH)=0.025mol•L-1•min-1;
平衡时c(H2)=1.5mol/L;平衡时CO2的转化率为50%.
③在其它条件不变下,若20min时向该密闭容器中通入1mol H2,此时该反应速率将增大(填“增大”或“减小”).
Ⅰ.脱硝:催化剂存在下,H2还原NO2生成水蒸气和其它无毒物质的化学方程式为4H2+2NO2$\frac{\underline{\;催化剂\;}}{\;}$N2+4H2O.
Ⅱ.脱碳:向2L密闭容器中加入2mol CO2、6mol H2,在恒温恒容的条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0
(1)下列叙述能说明此反应达到平衡状态的是bce.
a.单位时间内生成n mol CH3OH的同时生成n mol H2O
b.CO2和H2的物质的量分数保持不变
c.CO2和H2的浓度保持不变
d.混合气体的密度保持不变
e.生成1mol CO2生成的同时有3mol H-H键断裂
(2)该反应过程中部分数据见下表:
| 反应时间 | CO2 (mol) | H2 (mol) | CH3OH (mol) | H2O (mol) |
| 0min | 2 | 6 | 0 | 0 |
| 10min | 4.5 | |||
| 20min | 1 | |||
| 30min | 1 |
简述理由:20min时,n(CH3OH)为1mol,与30min时相同.
②前10min内的平均反应速率v(CH3OH)=0.025mol•L-1•min-1;
平衡时c(H2)=1.5mol/L;平衡时CO2的转化率为50%.
③在其它条件不变下,若20min时向该密闭容器中通入1mol H2,此时该反应速率将增大(填“增大”或“减小”).
16.化学与生活密切相关,下列说法不正确的是( )
| A. | 葡萄糖中的花青素在碱性环境下显蓝色,故可用苏打粉辨别真假葡萄酒 | |
| B. | 氨氮废水(含NH4+及NH3)可用化学氧化法或电化学氧化法处理 | |
| C. | 金属的防护中,牺牲阳极的阴极保护法利用的是原电池原理 | |
| D. | 84消毒液在日常生活中广泛应用,其有效成分是Ca(ClO)2 |
3.燃料电池是燃料(如甲烷等)跟O2(或空气)起反应将化学能转变为电能的装置,电解质溶液是强碱(如KOH )溶液,下列关于甲烷燃料电池的说法中不正确的是( )
| A. | 负极的电极反应式为:CH4+10OH--8e-═CO32-+7H2O | |
| B. | 通入氧气的一极发生氧化反应,通入甲烷的一极发生还原反应 | |
| C. | 随着反应的进行,电解质溶液的pH增大 | |
| D. | 甲烷燃料电池的能量利用率比甲烷燃烧的大 |
17.由2-氯丙烷制得少量的CH3CHOHCH2OH,需要经过下列几步反应( )
| A. | 消去→加成→取代 | B. | 加成→消去→取代 | C. | 取代→消去→加成 | D. | 消去→加成→消去 |
18.一种有机物的结构简式如图,关于它的性质不正确的说法是( )
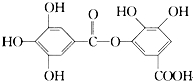

| A. | 它有酸性,1 mol该物质最多能与6 mol H2发生加成反应 | |
| B. | 在一定条件下,1 mol该物质最多能和4 mol Br2反应 | |
| C. | 它可以水解,水解产物为两种有机物 | |
| D. | 该有机物能发生取代反应 |
 用氢气和一氧化碳克制备洁净能源二甲醚(CH3OCH3),工业制备二甲醚时在催化反应室(压强为2.0~10.0MPa,温度为230~280℃)中进行下列反应:
用氢气和一氧化碳克制备洁净能源二甲醚(CH3OCH3),工业制备二甲醚时在催化反应室(压强为2.0~10.0MPa,温度为230~280℃)中进行下列反应: