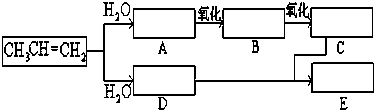
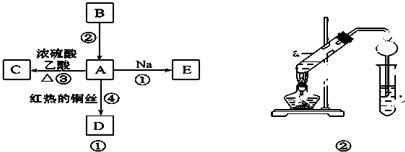
题目内容
将2.3g金属钠放入ag水中反应完全后溶液中钠离子与水分子的个数之比为1:50,求最后溶液中水的质量及a的值.
考点:化学方程式的有关计算
专题:
分析:根据n=
计算2.3gNa的物质的量,钠离子物质的量等于Na的物质的量,根据钠离子与水分子的个数之比计算水的物质的量,再根据m=nM计算溶液中水的质量;
根据2Na+2H2O=2NaOH+H2↑计算参加反应水的物质的量,再根据m=nM计算参加反应水的质量,进而计算水的总质量.
| m |
| M |
根据2Na+2H2O=2NaOH+H2↑计算参加反应水的物质的量,再根据m=nM计算参加反应水的质量,进而计算水的总质量.
解答:
解:2.3gNa的物质的量为
=0.1mol,钠离子物质的量等于Na的物质的量,根据钠离子与水分子的个数之比,可知反应后溶液中水的物质的量为0.1mol×50=5mol,则最后溶液中水的质量为5mol×18g/mol=90g,
根据2Na+2H2O=2NaOH+H2↑,可知参加反应水的物质的量为0.1mol,故参加反应水质量为0.1mol×18g/mol=1.8g,则水的总质量为90g+0.1mol×18g/mol=91.8g,
答:最后溶液中水的质量为90g,a的值为91.8.
| 2.3g |
| 23g/mol |
根据2Na+2H2O=2NaOH+H2↑,可知参加反应水的物质的量为0.1mol,故参加反应水质量为0.1mol×18g/mol=1.8g,则水的总质量为90g+0.1mol×18g/mol=91.8g,
答:最后溶液中水的质量为90g,a的值为91.8.
点评:本题考查化学方程式的有关计算,侧重对以物质的量为中心的有关计算,比较基础,有利于基础知识的巩固.

练习册系列答案
相关题目
下列离子方程式书写正确的是( )
| A、向氧化镁中加入硫酸溶液 Mg2++SO42-═MgSO4 |
| B、向水中加入钠块 2Na+2H2O═2Na++2OH-+H2↑ |
| C、向氢氧化钡溶液中加入过量硫酸氢钠溶液 H++SO42-+Ba2++OH-═BaSO4↓+H2O |
| D、铁跟稀硫酸反应 2Fe+6H+═2Fe3++3H2↑ |
某分子式为C10H20O2的酯,在一定条件下可发生如下图的转化过程:则符合上述条件的酯的结构可能有( )


| A、2种 | B、8种 | C、6种 | D、4种 |
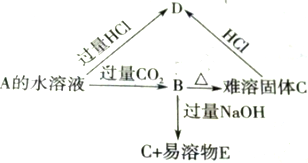 A、B、C、D、E 5种物质的转化关系如图所示.已知A为二元碱,微溶于水且溶解度随温度升高而降低
A、B、C、D、E 5种物质的转化关系如图所示.已知A为二元碱,微溶于水且溶解度随温度升高而降低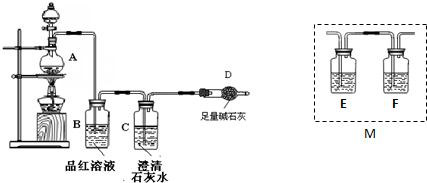
 X、Y、Z、W为按原子序数由小到大排列的四种短周期的元素.其中Y、W位于同一主族,Z、W位于同一周期;Y所组成的单质和氢化物中分别有一种具有漂白性;Z是同一周期中金属性最强的元素,X的某同位素原子的质子数与中子数相等且应用于核聚变反应.请回答下列问题:
X、Y、Z、W为按原子序数由小到大排列的四种短周期的元素.其中Y、W位于同一主族,Z、W位于同一周期;Y所组成的单质和氢化物中分别有一种具有漂白性;Z是同一周期中金属性最强的元素,X的某同位素原子的质子数与中子数相等且应用于核聚变反应.请回答下列问题: