��Ŀ����
������һ����Ҫ�Ļ���ԭ�ϣ����ĺϳɺ�Ӧ���ǵ�ǰ����Ҫ�о�����֮һ��
��1�������£���һ��2L���ܱ������г���1mol N2��2.6mol H2����Ӧ�����ж�NH3��Ũ�Ƚ��м�⣬�õ����������±���ʾ��
�������£��÷�Ӧ�ﵽ��ѧƽ��ʱ��������Ũ��Ϊ ��
��2��ϣ������˹��´�ѧ��Marmellos��Stoukides��һ������ĵ�ⷽ���ϳɰ������ڳ�ѹ�°��������ú���ϡ�͵ĵ������ֱ�ͨ�뵽570��ĵ����У��ø����ӵ����Ե�SCY�մɣ��ܴ���H+��Ϊ���ʣ������ٶྦྷ��Ĥ���缫��ת���ʸߴ�78%����ʵ��װ����ͼ�ף������ĵ缫��Ӧʽ ��

��3���ñ�����궨ij��ˮ��Ũ��ʱӦ��ѡ����������ָʾ����� ��
A������ B��ʯ�� C����̪
���� pC����pH����ָ��ϡ��Һ���������ʵ���Ũ�ȵij��ö�����ֵ������Һ��ij���ʵ�Ũ��Ϊ��1��10��3mol?L��1����pC=-lg��1��10��3��=3��ij�¶��£�H2CO3��Һ��pC-pH��ϵ��ͼ�ң�
��ش��������⣺
��1��pH=2��4ʱ��H2CO3��Һ����Ҫ���ڵ�����Ϊ ��
��2������¶���H2CO3?H++HCO3�� �ĵ���ƽ�ⳣ�� ��
��3���ܹ��ֿ�������������Ӱ�졢�������� pH�仯�������Һ����֮Ϊ������Һ����Ũ�Ⱦ�Ϊ0.1mol?L��1��NaHCO3��Na2CO3�����Һ����һ�ֻ�����Һ�����������������ƽ��HCO3��?H++CO32���ƶ�����Һ��H+Ũ�ȱ仯������������Ϣ��ȷ����ˮ���Ȼ�淋Ļ����Һ�ܲ����γɻ�����Һ ��
��1�������£���һ��2L���ܱ������г���1mol N2��2.6mol H2����Ӧ�����ж�NH3��Ũ�Ƚ��м�⣬�õ����������±���ʾ��
| ʱ��/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c��NH3��/�� mol?L��1�� | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
��2��ϣ������˹��´�ѧ��Marmellos��Stoukides��һ������ĵ�ⷽ���ϳɰ������ڳ�ѹ�°��������ú���ϡ�͵ĵ������ֱ�ͨ�뵽570��ĵ����У��ø����ӵ����Ե�SCY�մɣ��ܴ���H+��Ϊ���ʣ������ٶྦྷ��Ĥ���缫��ת���ʸߴ�78%����ʵ��װ����ͼ�ף������ĵ缫��Ӧʽ

��3���ñ�����궨ij��ˮ��Ũ��ʱӦ��ѡ����������ָʾ�����
A������ B��ʯ�� C����̪
���� pC����pH����ָ��ϡ��Һ���������ʵ���Ũ�ȵij��ö�����ֵ������Һ��ij���ʵ�Ũ��Ϊ��1��10��3mol?L��1����pC=-lg��1��10��3��=3��ij�¶��£�H2CO3��Һ��pC-pH��ϵ��ͼ�ң�
��ش��������⣺
��1��pH=2��4ʱ��H2CO3��Һ����Ҫ���ڵ�����Ϊ
��2������¶���H2CO3?H++HCO3�� �ĵ���ƽ�ⳣ��
��3���ܹ��ֿ�������������Ӱ�졢�������� pH�仯�������Һ����֮Ϊ������Һ����Ũ�Ⱦ�Ϊ0.1mol?L��1��NaHCO3��Na2CO3�����Һ����һ�ֻ�����Һ�����������������ƽ��HCO3��?H++CO32���ƶ�����Һ��H+Ũ�ȱ仯������������Ϣ��ȷ����ˮ���Ȼ�淋Ļ����Һ�ܲ����γɻ�����Һ
���㣺���������ˮ��Һ�еĵ���ƽ��,��ѧƽ��ļ���,����ˮ���Ӧ��,�ζ�ʵ����ָʾ����ʹ��
ר�⣺��ѧƽ��ר��,����ƽ������Һ��pHר��
����������1������ͼ�������ж�ƽ��ʱ����Ũ��Ϊ0.20mol/L�������ʼ�������û�ѧƽ������ʽ��ʽ����ƽ��Ũ�ȣ�
��2�����ص����������õ��ӵĻ�ԭ��Ӧ��
��3���ñ�����궨ij��ˮ��Ũ��ʱӦ��ѡ���������Ϊָʾ����
����1������ͼ�е�������ȷ��pH=2��4ʱ��H2CO3��Һ����Ҫ���ڵ����ӣ�
��2�����ݵ���ƽ�ⳣ������ʽ�������ݽ��м��㣻
��3���ܹ��ֿ�������������Ӱ�졢��������pH�仯�������Һ����֮Ϊ������Һ����ϰ�ˮ�ĵ����笠����ӵ�ˮ�����жϣ�
��2�����ص����������õ��ӵĻ�ԭ��Ӧ��
��3���ñ�����궨ij��ˮ��Ũ��ʱӦ��ѡ���������Ϊָʾ����
����1������ͼ�е�������ȷ��pH=2��4ʱ��H2CO3��Һ����Ҫ���ڵ����ӣ�
��2�����ݵ���ƽ�ⳣ������ʽ�������ݽ��м��㣻
��3���ܹ��ֿ�������������Ӱ�졢��������pH�仯�������Һ����֮Ϊ������Һ����ϰ�ˮ�ĵ����笠����ӵ�ˮ�����жϣ�
���
�⣺����1��ͼ�������ж�ƽ��ʱ����Ũ��Ϊ0.20mol/L�����ʵ���Ϊ0.20mol/L��2L=0.40mol�������ʼ�������û�ѧƽ������ʽ��ʽ����ƽ��Ũ��
N2 +3H2 =2NH3
��ʼ����mol�� 1 2.6 0
�仯����mol�� 0.2 0.6 0.4
ƽ������mol�� 0.8 2 0.4
�õ�ƽ�������Ũ��c��N2��
=0.4mol/L��
�ʴ�Ϊ��0.4mol/L��
��2���ڵ����У����������õ��ӵĻ�ԭ��Ӧ�������Խ����£������õ��ӵĹ���Ϊ��N2+6e-+6H+=2NH3��
�ʴ�Ϊ��N2+6e-+6H+=2NH3��
��3���ñ�����궨ij��ˮ��Ũ��ʱ������ǡ�÷�Ӧ���ɵ��Ȼ�������ԣ������ȵı�ɫ��ΧΪ3.1-4.4��ѡ������ܽ��͵ζ���
�ʴ�Ϊ��A��
����1������ij�¶��£�H2CO3��Һ��pC-pH��ϵͼ�����Եó�pH=2��4ʱ��H2CO3��Һ����Ҫ���ڵ�����ΪH+��HCO3-��
�ʴ�Ϊ��H+��HCO3-��
��2����ͼ���֪����pH=0ʱ��H+��HCO3-��H2CO3��pC�ֱ�Ϊ��0��9��3��������Ũ�ȷֱ�Ϊ��1mol/L��10-9mol/L��10-3mol/L�����¶���H2CO3?H++HCO3-�ĵ���ƽ�ⳣ��K=
=
=10-6mol/L��
�ʴ�Ϊ��10-6mol/L��
��3����ˮ�ĵ����ܲ���笠����ӣ�笠�����ˮ���ܲ���һˮ�ϰ����ӣ���ˮ���Ȼ�淋Ļ����Һ�ܹ��ֿ�������������Ӱ�죬
��������pH�仯�������γɻ�����Һ��
�ʴ�Ϊ���ܣ�
N2 +3H2 =2NH3
��ʼ����mol�� 1 2.6 0
�仯����mol�� 0.2 0.6 0.4
ƽ������mol�� 0.8 2 0.4
�õ�ƽ�������Ũ��c��N2��
| 0.8mol |
| 2L |
�ʴ�Ϊ��0.4mol/L��
��2���ڵ����У����������õ��ӵĻ�ԭ��Ӧ�������Խ����£������õ��ӵĹ���Ϊ��N2+6e-+6H+=2NH3��
�ʴ�Ϊ��N2+6e-+6H+=2NH3��
��3���ñ�����궨ij��ˮ��Ũ��ʱ������ǡ�÷�Ӧ���ɵ��Ȼ�������ԣ������ȵı�ɫ��ΧΪ3.1-4.4��ѡ������ܽ��͵ζ���
�ʴ�Ϊ��A��
����1������ij�¶��£�H2CO3��Һ��pC-pH��ϵͼ�����Եó�pH=2��4ʱ��H2CO3��Һ����Ҫ���ڵ�����ΪH+��HCO3-��
�ʴ�Ϊ��H+��HCO3-��
��2����ͼ���֪����pH=0ʱ��H+��HCO3-��H2CO3��pC�ֱ�Ϊ��0��9��3��������Ũ�ȷֱ�Ϊ��1mol/L��10-9mol/L��10-3mol/L�����¶���H2CO3?H++HCO3-�ĵ���ƽ�ⳣ��K=
| c(H+)?c(HCO3-) |
| c(H2CO3) |
| 1��10-9 |
| 10-3 |
�ʴ�Ϊ��10-6mol/L��
��3����ˮ�ĵ����ܲ���笠����ӣ�笠�����ˮ���ܲ���һˮ�ϰ����ӣ���ˮ���Ȼ�淋Ļ����Һ�ܹ��ֿ�������������Ӱ�죬
��������pH�仯�������γɻ�����Һ��
�ʴ�Ϊ���ܣ�
���������⿼��Ƕȹ㣬�ۺ��Խ�ǿ��Ҫ��ѧ�����з����ͽ��������������Ѷȴ�Ҫ������������ж�ƽ��ͼ���ƽ�ⳣ����

��ϰ��ϵ�д�
 ��У����ϵ�д�
��У����ϵ�д�
�����Ŀ
 �����£���20mL 0.1mol/L��ʯ�ᣨ��H2T��ʾ����Һ����εμӵ����ʵ���Ũ�ȵ�NaOH��Һ���й��������ʵ���������Һ��pH����ͼ��ϵ������˵����ȷ���ǣ�������
�����£���20mL 0.1mol/L��ʯ�ᣨ��H2T��ʾ����Һ����εμӵ����ʵ���Ũ�ȵ�NaOH��Һ���й��������ʵ���������Һ��pH����ͼ��ϵ������˵����ȷ���ǣ�������| A��VNaOH=10mLʱ����Һ�д���[Na+]=2[H2T]+2[HT-]+2[T2-] |
| B��VNaOH=20mLʱ����Һ�д���[Na+]��[HT-]��[H+]��[H2T]��[T2-] |
| C��VNaOH=30mLʱ����Һ�д���[Na+]��[HT-]��[T2-]��[OH-]��[H+] |
| D��VNaOH=40mLʱ����Һ�д���[OH-]=[HT-]+2[H2T]+[H+] |
�����£����и���������ָ����Һ���ܴ���������ǣ�������
| A������KSCN��Һ�Ժ�ɫ����Һ��K+��NH4+��Cl-��NO3- | ||
B�������£�
| ||
| C�������̪��Һ�Ժ�ɫ����Һ��Mg2+��Al3+��Br-��SO42- | ||
| D�����ܽ�Al2O3����Һ��Na+��Ca2+��HCO3-��NO3- |
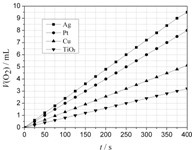 ijЩ�����������������H2O2�ķֽⷴӦ���д����ã���ش��������⣺
ijЩ�����������������H2O2�ķֽⷴӦ���д����ã���ش��������⣺