题目内容
下列有关实验原理或实验操作正确的是( )


| A、用甲装置验证铜与稀硝酸的反应产物只有NO |
| B、通过乙装置实现化学反应:2Cu+O2+4H+=2Cu2++2H2O |
| C、用适量铜粉除去CuCl2溶液中少量的FeCl3 |
| D、用水湿润的pH试纸测量某溶液的pH |
考点:原电池和电解池的工作原理,硝酸的化学性质
专题:
分析:A.装置中有空气,会生成二氧化氮;
B.乙装置,为原电池;
C.Cu与氯化铁反应生成氯化亚铁和氯化铜;
D.用水湿润试纸会使溶液被稀释.
B.乙装置,为原电池;
C.Cu与氯化铁反应生成氯化亚铁和氯化铜;
D.用水湿润试纸会使溶液被稀释.
解答:
解:A.装置中有空气,会生成二氧化氮,应先利用惰性气体将装置中的空气排出,则甲装置不能验证铜与稀硝酸的反应产物是NO,故A错误;
B.乙装置,为原电池,常温下能发生的氧化还原反应可实现,则通过乙装置实现化学反应:2Cu+O2+4H+=2Cu2++2H2O,故B正确;
C.Cu与氯化铁反应生成氯化亚铁和氯化铜,会引入新杂质氯化亚铁,故C错误;
D.用水湿润试纸会使溶液被稀释,溶液的浓度减小,测定的pH可能有误差,故D错误;
故选B.
B.乙装置,为原电池,常温下能发生的氧化还原反应可实现,则通过乙装置实现化学反应:2Cu+O2+4H+=2Cu2++2H2O,故B正确;
C.Cu与氯化铁反应生成氯化亚铁和氯化铜,会引入新杂质氯化亚铁,故C错误;
D.用水湿润试纸会使溶液被稀释,溶液的浓度减小,测定的pH可能有误差,故D错误;
故选B.
点评:本题考查化学实验方案的评价,涉及物质的性质、原电池和氧化还原反应、除杂、pH试纸的使用等,把握化学反应原理及装置的作用为解答的关键,注意除杂不能引入新杂质,题目难度不大.

练习册系列答案
相关题目
已知反应A2(g)+2B2(g)?2AB2(g)△H<0,下列说法正确的是( )
| A、升高温度,正向反应速率增加,逆向反应速率减小 |
| B、升高温度有利于反应速率增加,从而缩短达到平衡的时间 |
| C、达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动 |
| D、达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动 |
沼气是一种能源,它主要是CH4,常温下0.5mol CH4完全燃烧生成CO2和H2O时,放出445kJ的热量,则下列热化学方程式中正确的是( )
| A、2 CH4(g)+4O2(g)=2CO2(g)+4H2O(l);△H=+890kJ/mol |
| B、CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H=+890kJ/mol |
| C、CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H=-890kJ/mol |
| D、0.5CH4(g)+O2(g)=0.5CO2(g)+H2O(l);△H=-890kJ/mol |
对于锌、铜和稀硫酸组成的原电池(如图).下列说法正确的是( )


| A、Zn是正极 |
| B、铜是负极 |
| C、铜片上有气泡产生 |
| D、氢离子在铜片表面被氧化 |
下列关于铝的说法错误的是( )
| A、铝的表面容易形成致密的氧化膜,抗腐蚀性能好 |
| B、常温下不与任何酸、碱反应 |
| C、铝元素在地壳中的含量高,储量丰富 |
| D、工业上可以用电解法冶炼铝 |
足量铁粉与一定量盐酸反应,为了减慢反应速率,但不减少氢气的产量,可加入下列物质中的( )
| A、NaNO3固体 |
| B、NaOH固体 |
| C、Na2CO3固体 |
| D、NaCl溶液 |
有机物的种类繁多,但其命名是有规则的.下列有机物用系统命名法命名正确的是( )
A、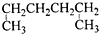 1,4-二甲基丁烷 |
B、 3-甲基丁烯 |
C、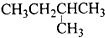 2-甲基丁烷 |
D、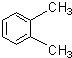 对二甲苯 |