题目内容
8.下列各组物质的性质比较,从强到弱的顺序正确的是( )| A. | 单质熔点 Al>Mg>K>Na>Li | B. | 沸点 HI>HBr>HCl>HF | ||
| C. | 酸性 HClO4>H2SO4>H3PO4>H2SiO3 | D. | 稳定性 AsH3>PH3>NH3 |
分析 A.电荷越大,离子半径越小,对应金属单质的熔点越大;
B.HF分子间含氢键,沸点最高,其它氢化物的相对分子质量越大,沸点越大;
C.非金属性越强,对应最高价含氧酸的酸性越强;
D.非金属性越强,对应氢化物越稳定.
解答 解:A.电荷越大,离子半径越小,对应金属单质的熔点越大,则单质熔点 Al>Mg>Li>Na>K,故A错误;
B.HF分子间含氢键,沸点最高,其它氢化物的相对分子质量越大,沸点越大,则沸点 HF>HI>HBr>HCl,故B错误;
C.非金属性越强,对应最高价含氧酸的酸性越强,则酸性 HClO4>H2SO4>H3PO4>H2SiO3,故C正确;
D.非金属性越强,对应氢化物越稳定,则稳定性 AsH3<PH3<NH3,故D错误;
故选C.
点评 本题考查元素周期表和周期律,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案
相关题目
6.仪器名称为“蒸发皿”的是( )
| A. |  | B. |  | C. |  | D. |  |
13.a g密度为d1 g/cm3质量分数为ω1的硝酸钾溶液,采取某种措施变成bg密度为d2g/cm3质量分数为ω2的硝酸钾饱和溶液,下列表达一定正确的是( )
| A. | a>b | B. | d1>d2 | C. | bω2≥aω1 | D. | a d1ω1=b d2ω2 |
20.将某些化学知识用数轴表示,可以收到直观形象、简明易记的效果.用数轴表示的下列化学知识中正确的是( )
| A. | 分散系的分类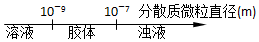 | |
| B. | Fe与Cl2反应的产物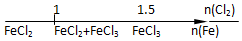 | |
| C. | 向AlCl3溶液滴加NaOH溶液后铝的存在形式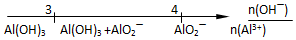 | |
| D. | Na与O2反应的产物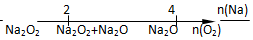 |
17.某化学小组为测定一定质量的铜铝混合物中铜的质量分数,设计了如下实验方案:
方案Ⅰ:铜铝混合物 $→_{充分反应}^{足量溶液A}$测定生成气体的体积
方案Ⅱ:铜铝混合物 $→_{充分反应}^{足量溶液B}$ 测定剩余固体的质量
下列有关判断中不正确的是( )
方案Ⅰ:铜铝混合物 $→_{充分反应}^{足量溶液A}$测定生成气体的体积
方案Ⅱ:铜铝混合物 $→_{充分反应}^{足量溶液B}$ 测定剩余固体的质量
下列有关判断中不正确的是( )
| A. | 溶液A和B均可以是盐酸或NaOH溶液 | |
| B. | 若溶液B选用浓H2SO4,反应条件需要加热,剩余固体为铝 | |
| C. | 溶液A和B均不可选用稀HNO3 | |
| D. | 实验室中方案Ⅱ更容易实施 |
 .
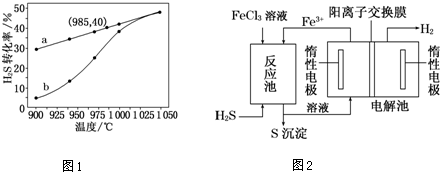
.



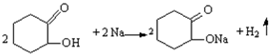 反应E→G的方程式为:HOOC(CH2)4COOH+2NaHCO3→NaOOC(CH2)4COONa+2CO2↑+2H2O.
反应E→G的方程式为:HOOC(CH2)4COOH+2NaHCO3→NaOOC(CH2)4COONa+2CO2↑+2H2O.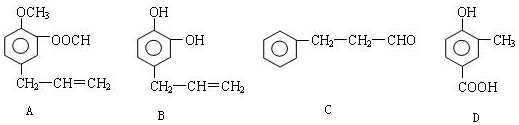
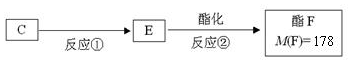
 .
.
 .
. ,反应类型是酯化反应(或取代反应).
,反应类型是酯化反应(或取代反应). .
.