题目内容
8.人类对于晶体结构的持续探究揭开了晶体内部的奥秘,并合成了许许多多的新物质、新材料.回答下列问题: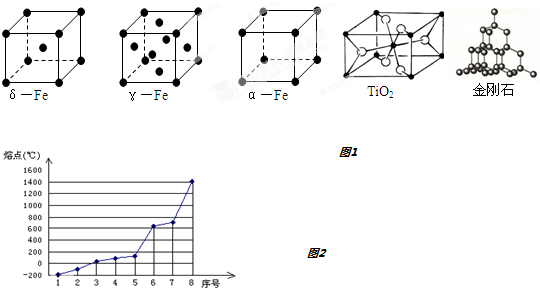
(1)铁有δ、γ、α三种同素异形体,γ晶体晶胞中所含有的铁原子数为4,δ、α两种晶胞中铁原子的配位数之比为4:3.
(2)TiO2的天然晶体中,最稳定的一种晶体结构如图1,白球表示:氧原子.
(3)NaCl、CO2、SiO2三种晶体熔点由低到高的顺序是CO2<NaCl<SiO2.
(4)第三周期八种元素按单质熔点由低到高的顺序排列如图2所示,其中序号1和8分别代表的是Ar和Si.
(5)已知:Cr3+可形成配位数为6的配合物.组成为CrCl3•6H2O的配合物有3种,分别呈紫色、蓝绿色、绿色,为确定这3种配合物的成键情况,分别取等质量的紫色、蓝绿色、绿色3种物质的样品配成溶液,分别向其中滴入过量的AgNO3溶液,均产生白色沉淀且质量比为3:2:1.则绿色配合物的化学式为B(选填代号).
A.[CrCl(H2O)5]Cl2•H2O B.[CrCl2(H2O)4]Cl•2H2O
C.[Cr(H2O)6]Cl3 D.[CrCl3(H2O)3]•3H2O
(6)根据下表所示键能,写出金刚石(结构如图1)完全燃烧时的热化学方程式2C(s)+O2(g)=2CO(g)△H=(2a+b-2c)kJ•mol-1
| 共价键 | C-C | O=O | C=O |
| 键能/kJ•mol-1 | a | b | c |
分析 (1)利用均摊法计算γ晶体晶胞中所含有的铁原子数;先判断δ、α两种晶胞中铁原子的配位数,再计算其比值;
(2)根据均摊法计算出验原子数目;
(3)熔点的一般规律:原子晶体>离子晶体>分子晶体;
(4)第三周期八种元素的单质中只有Si为原子晶体,熔点最大,熔沸点:原子晶体>金属晶体>分子晶体,分子晶体有氩气、氯气、硫、磷,氯气相对分子质量高于氩气,其熔点仅高于氩气;
(5)根据配合物中外界能电离,内界不能电离,以及1个配合物中最多能电离出3个氯离子来解答;
(6)金刚石燃烧的方程式为:C+O2=CO2,根据化学键的断裂和形成的数目进行计算反应热,然后写出热化学方程式;
解答 解:(1)该晶胞中顶点上含有的原子数=8×$\frac{1}{8}$=1,面心上含有的原子数=6×$\frac{1}{2}$=3,所以一个晶胞中含有4个原子;δ、α两种晶胞中铁原子的配位数分别是8个和6个,所以δ、α两种晶胞中铁原子的配位数之比是4:3.
故答案为:4;4:3;
(2)黑球的数目=8×$\frac{1}{8}$+1=2,白球数目=4×$\frac{1}{2}$=4,黑白球比例为1:2,故白球是氧;
故答案为:氧;
(3)NaCl属于离子晶体,CO2属于分子晶体,SiO2属于原子晶体,则熔点:CO2<NaCl<SiO2;
故答案为:CO2<NaCl<SiO2;
(4)第三周期八种元素的单质中只有Si为原子晶体,熔点最大,熔沸点:原子晶体>金属晶体>分子晶体,分子晶体有氩气、氯气、硫、磷,氯气相对分子质量高于氩气,其熔点仅高于氩气,所以序号1和8分别代表的是Ar、Si;
故答案为:Ar;Si;
(5)分别取等质量的紫色、蓝绿色、绿色3种物质的样品配成溶液,分别向其中滴入过量的AgNO3溶液,均产生白色沉淀且质量比为3:2:1,说明外界中的氯离子个数之比为:3:2:1,1个配合物中最多能电离出3个氯离子,所以绿色配合物中外界中的氯离子个数是1个,则内界有2个氯离子、4个水分子,化学式为[CrCl2(H2O)4]Cl•2H2O;
故选B.
(6)金刚石燃烧的方程式为C+O2=CO2,因为在金刚石结构中平均1mol碳形成2mol碳碳单键,所以1mol金刚石完全燃烧需拆开2mol C-C、1mol O=O,形成2molC=O,所以反应热△H=(2a+b-2c)kJ•mol-1,热化学方程式为:2C(s)+O2(g)=2CO(g)△H=(2a+b-2c)kJ•mol-1;
故答案为:2C(s)+O2(g)=2CO(g)△H=(2a+b-2c)kJ•mol-1;
点评 本题考查晶胞的计算、晶体类型与性质,配合物的结构与性质,反应热的计算等,特别是注意分析金刚石的结构,正确判断共价键的数目是计算难点,学习中要准确把握.

 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案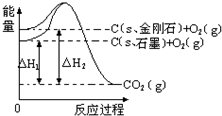
| A. | 石墨和金刚石的转化是物理变化 | |
| B. | C(s、石墨)=C(s、金刚石)△H=+1.9 kJ•mol-1 | |
| C. | 金刚石的稳定性强于石墨 | |
| D. | 1 mol石墨的总键能比1 mol金刚石的总键能小 |
| A. | MgO | B. | SiO2 | C. | CO | D. | NaOH |
| A. | NA=$\frac{12}{b}$ | |
| B. | Wg${\;}_{72}^{185}$Hf的物质的量为$\frac{W}{a{N}_{A}}$mol | |
| C. | ${\;}_{72}^{185}$Hf的摩尔质量为$\frac{2a}{b}$g•mol-1 | |
| D. | 等物质的量的${\;}_{72}^{185}$Hf、12C的质量之比为b:a |
| A. | 硝酸见光易分解,故需保存在棕色瓶中 | |
| B. | Na2CO3、NaAlO2溶液显碱性,故只能用橡胶塞保存 | |
| C. | FeCl2溶液保存时需加入少量铁粉和盐酸 | |
| D. | 少量白磷可保存在煤油中 |
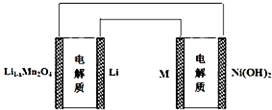
| A. | 锂离子电池放电时Li+向正极迁移 | |
| B. | 锂离子电池充电时,阴极的电极反应式:LiMn2O4-xe-═Li1-xMn2O4+xLi+ | |
| C. | 如图表示用锂离子电池给镍氢电池充电 | |
| D. | 镍氢电池放电时,负极的电极反应式:MH+OH--e-═H2O+M |
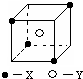 某离子晶体晶胞结构如图所示,x位于立方体的顶点,Y位于立方体中心.试分析:
某离子晶体晶胞结构如图所示,x位于立方体的顶点,Y位于立方体中心.试分析: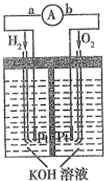 氢氧燃料电池是符合绿色化学理念的新型发电装置.图为电池示意图,该电池电极表面镀一层细小的铂粉(金属铂吸附气体的能力强,性质稳定).请回答:
氢氧燃料电池是符合绿色化学理念的新型发电装置.图为电池示意图,该电池电极表面镀一层细小的铂粉(金属铂吸附气体的能力强,性质稳定).请回答: 己知A、B、C、D、E五种元素,均位于周期表的前四周期,它们的核电荷数依次增加.A元素核内只有质子,B原子的L层p轨道中有2个电子,C的原子核外有三个未成对电子,D原子核外电子排布为nsnnpn+2,E是第四周期元素,最外层只有一个电子,其余各层电子均充满.
己知A、B、C、D、E五种元素,均位于周期表的前四周期,它们的核电荷数依次增加.A元素核内只有质子,B原子的L层p轨道中有2个电子,C的原子核外有三个未成对电子,D原子核外电子排布为nsnnpn+2,E是第四周期元素,最外层只有一个电子,其余各层电子均充满.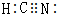 .
.