题目内容
碱性电池具有容量大、放电电流大的特点,因而得到广泛使用,锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应为:Zn(s)+2MnO2(s)+H2O(l)﹦Zn(OH)2(s)+Mn2O3(s)下列说法错误的是( )
| A、电池工作时,锌失去电子 |
| B、反应时化学能转化为电能 |
| C、电池工作时,电子由正极通过外电路流向负极 |
| D、外电路中每通过0.2mol电子,锌的质量理论上减小6.5g |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:原电池中,Zn失电子作负极,负极反应式为Zn-2e-+2OH-═Zn(OH)2,MnO2得电子为正极,正极反应式为2MnO2+H2O+2e-=Mn2O3+2OH-,放电时电子从负极沿导线流向正极,据此分析解答.
解答:
解:A、原电池工作原理是:负极失电子,发生氧化反应,根据总反应可知失电子的是金属锌,故A正确;
B、原电池是向外提供电能的装置,则反应时化学能转化为电能,故B正确;
C、电池工作时,电子由负极流向正极,故C错误;
D、根据电池反应Zn(s)+2MnO2(s)+H2O(l)﹦Zn(OH)2(s)+Mn2O3(s),消耗1mol的金属锌,转移电子是2mol,所以当外电路中每通过0.2mol电子,消耗金属锌0.1mol,锌的质量理论上减小0.1mol×65g/mol=6.5g,故D正确.
故选C.
B、原电池是向外提供电能的装置,则反应时化学能转化为电能,故B正确;
C、电池工作时,电子由负极流向正极,故C错误;
D、根据电池反应Zn(s)+2MnO2(s)+H2O(l)﹦Zn(OH)2(s)+Mn2O3(s),消耗1mol的金属锌,转移电子是2mol,所以当外电路中每通过0.2mol电子,消耗金属锌0.1mol,锌的质量理论上减小0.1mol×65g/mol=6.5g,故D正确.
故选C.
点评:本题考查原电池原理,明确正负极反应、正负极的判断、电子流向即可解答,难点是电极反应式的书写,题目难度不大.

练习册系列答案
 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案
相关题目
下列变化中一定要加入还原剂才能实现的是( )
| A、KMnO4←MnO2 |
| B、NH3→N2 |
| C、FeCl3→Fe |
| D、KClO3→KCl |
现有甲、乙、丙、丁和Fe(OH)3等五种胶体,按甲和丙、乙和丁、丙和丁、乙和胶体Fe(OH)3两两混合,均出现胶体聚沉现象.则粒子带负电荷的胶体是( )
| A、甲和乙 |
| B、丙和乙 |
| C、甲和丁 |
| D、丙和Fe(OH)3胶体 |
有机物A可氧化为B(分子式为C2H3O2Br),而A水解得到C,1molC和2molB反应可得到含Br的酯D(分子式为C6H8O4Br2),由此推断A的结构简式为( )
| A、BrCH2CH2OH |
| B、BrCH2CHO |
| C、HOCH2CH2OH |
| D、BrCH2COOH |
下列化学事实及其结论都正确的是( )
| A、铝制饮具最好不要盛放酸性、或碱性较强的液体食物,因为Al和Al2O3既可以与酸反应、又可以与碱反应 |
| B、将SO2通入含HClO的溶液中,生成H2SO4,说明HClO酸性比H2SO4 强 |
| C、FeCl3溶液可以腐蚀线路板上的Cu,说明Fe的金属活动性大于Cu |
| D、过量的铜屑与稀硝酸作用,反应停止后,再加入1mol/L稀硫酸,铜屑又逐渐溶解是因为铜可直接与1mol/L稀硫酸反应 |
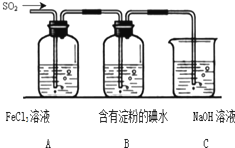 为探究SO2气体的还原性某兴趣小组设计了如图装置图:
为探究SO2气体的还原性某兴趣小组设计了如图装置图: