题目内容
按要求填空:
(1)某溶液中只含有K+、Al3+、Cl-、SO42- 四种离子,已知前三种离子的个数比为3:2:1,则溶液中Al3+和 SO42-的离子个数比为
(2)汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3=K2O+5Na2O+16N2↑,回答下列问题:
①该反应中的氧化剂是 .
②用单线桥表示此反应转移的电子数目及方向 .
③若氧化产物比还原产物多1.75mol,上述反应转移的电子数目为 .
(3)镁、铝合金3g与100mL稀H2SO4恰好完全反应,将反应后所得溶液蒸干,得无水硫酸盐17.4g,则原硫酸溶液的物质的量浓度为 .
(1)某溶液中只含有K+、Al3+、Cl-、SO42- 四种离子,已知前三种离子的个数比为3:2:1,则溶液中Al3+和 SO42-的离子个数比为
(2)汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3=K2O+5Na2O+16N2↑,回答下列问题:
①该反应中的氧化剂是
②用单线桥表示此反应转移的电子数目及方向
③若氧化产物比还原产物多1.75mol,上述反应转移的电子数目为
(3)镁、铝合金3g与100mL稀H2SO4恰好完全反应,将反应后所得溶液蒸干,得无水硫酸盐17.4g,则原硫酸溶液的物质的量浓度为
考点:氧化还原反应的计算,物质的量的相关计算,有关混合物反应的计算
专题:
分析:(1)溶液中Al3+、K+、Cl-个数比为1:3:2,令物质的量分别为1mol、3mol、2mol,根据电荷守恒有3n(Al3+)+n(K+)=n(Cl-)+2n(SO42-),据此计算n(SO42-),进而溶液中K+和SO42-的离子个数比;
(2)①化合价降低元素所在的反应物是氧化剂;
②氧化还原反应中,化合价降低值=化合价升高值=转移电子数,据此表示电子转移情况;
③该反应中N元素化合价由-
价、+5价变为0价,所以氧化产物和还原产物都是氮气,假设有16mol氮气生成,氧化产物是15mol、还原产物是1mol,则氧化产物比还原产物多14mol,若氧化产物比还原产物多1.75mol,则参加反应的n(KNO3)=
=0.25mol,再结合各个物理量之间的关系式计算;
(3)镁、铝合金3g与100mL稀H2SO4恰好完全反应,将反应后所得溶液蒸干,得无水硫酸盐17.4g为硫酸镁和硫酸铝的质量,根据镁、铝质量守恒计算硫酸根的质量,再计算出硫酸根的物质的量,利用硫酸根守恒计算溶质硫酸的物质的量,据此解答硫酸的物质的量浓度.
(2)①化合价降低元素所在的反应物是氧化剂;
②氧化还原反应中,化合价降低值=化合价升高值=转移电子数,据此表示电子转移情况;
③该反应中N元素化合价由-
| 1 |
| 3 |
| 1.75mol |
| 14mol |
(3)镁、铝合金3g与100mL稀H2SO4恰好完全反应,将反应后所得溶液蒸干,得无水硫酸盐17.4g为硫酸镁和硫酸铝的质量,根据镁、铝质量守恒计算硫酸根的质量,再计算出硫酸根的物质的量,利用硫酸根守恒计算溶质硫酸的物质的量,据此解答硫酸的物质的量浓度.
解答:
解:(1)溶液中Al3+、K+、Cl-个数比为1:3:2,令物质的量分别为1mol、3mol、2mol,
根据电荷守恒有3n(Al3+)+n(K+)=n(Cl-)+2n(SO42-),
即3×1mol+3mol=2mol+2n(SO42-),故n(SO42-)=2mol,
所以溶液中Al3+和SO42-的离子个数比为:1mol:2mol=1:2,
故答案为:1:2;
(2)①该反应中N元素化合价由-
价、+5价变为0价,化合价降低的N元素所在的反应物KNO3是氧化剂,故答案为:KNO3;
②该氧化还原反应中,化合价降低值=化合价升高值=转移电子数=10,电子转移情况为 ,
,
故答案为: ;
;
③该反应中N元素化合价由-
价、+5价变为0价,所以氧化产物和还原产物都是氮气,假设有16mol氮气生成,氧化产物是15mol、还原产物是1mol,则氧化产物比还原产物多14mol,若氧化产物比还原产物多1.75mol,则参加反应的n(KNO3)=
=0.25mol,转移电子的物质的量=5×0.25mol=1.25mol,转移的电子数目为1.25NA,故答案为:1.25NA;
(3)17.4g为硫酸镁和硫酸铝的质量,
由于镁、铝合金3g,所以17.4g中硫酸根的质量为17.4g-3g=14.4g,
所以硫酸根的物质的量为
=0.15mol,
所以100mL稀H2SO4含有溶质硫酸的物质的量为0.15mol,
所以该稀硫酸的浓度为
=1.5mol/L,
故答案为:1.5 mol/L.
根据电荷守恒有3n(Al3+)+n(K+)=n(Cl-)+2n(SO42-),
即3×1mol+3mol=2mol+2n(SO42-),故n(SO42-)=2mol,
所以溶液中Al3+和SO42-的离子个数比为:1mol:2mol=1:2,
故答案为:1:2;
(2)①该反应中N元素化合价由-
| 1 |
| 3 |
②该氧化还原反应中,化合价降低值=化合价升高值=转移电子数=10,电子转移情况为
 ,
,故答案为:
 ;
;③该反应中N元素化合价由-
| 1 |
| 3 |
| 1.75mol |
| 14mol |
(3)17.4g为硫酸镁和硫酸铝的质量,
由于镁、铝合金3g,所以17.4g中硫酸根的质量为17.4g-3g=14.4g,
所以硫酸根的物质的量为
| 14.4g |
| 96g/mol |
所以100mL稀H2SO4含有溶质硫酸的物质的量为0.15mol,
所以该稀硫酸的浓度为
| 0.15mol |
| 0.1L |
故答案为:1.5 mol/L.
点评:本题考查物质的量的有关计算、氧化还原反应,根据元素化合价变化结合各个物理量之间的关系式分析解答,注意氮化钠中N元素化合价,该反应的氧化产物和还原产物都是氮气,知道氧化产物和还原产物的物质的量之比,为易错点,难度大.

练习册系列答案
相关题目
下列说法不正确的是( )
| A、聚乙烯是纯净物 |
| B、光照条件下,2,2二甲基丙烷与Br2反应,其一溴代物只有一种 |
| C、苯酚俗称石炭酸,其水溶液呈弱酸性 |
| D、1溴丙烷和2溴丙烷分别与NaOH的乙醇溶液共热,所得产物相同 |
常温下,下列叙述正确的是( )
| A、当温度升高时,弱酸的电离平衡常数Ka变小 | ||
| B、常温下pH=3的乙酸溶液,c(H+)>c(OH-)>c(CH3COO-) | ||
| C、pH=4的醋酸与pH=10的氢氧化钠溶液等体积混合,所得溶液pH>7 | ||
D、向0.1mol?L-1的醋酸溶液中加水或通入HCl气体能使
|
化学与生活密切相关.下列说法不正确的是( )
| A、大量燃烧化石燃料是造成雾霾天气的一种重要因素 |
| B、裂化汽油、花生油均能使溴的四氯化碳溶液褪色 |
| C、用聚乙烯塑料代替聚乳酸塑料可减少白色污染 |
| D、可用浸泡过高锰酸钾溶液的硅藻土保鲜水果 |
未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生.下列属于未来新能源标准的是( )
①太阳能 ②生物质能 ③风能 ④氢能 ⑤煤 ⑥石油 ⑦天然气 ⑧核能.
①太阳能 ②生物质能 ③风能 ④氢能 ⑤煤 ⑥石油 ⑦天然气 ⑧核能.
| A、①②③④ | B、⑤⑥⑦⑧ |
| C、①②③④⑧ | D、①③④⑦⑧ |
氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于区域3的是( )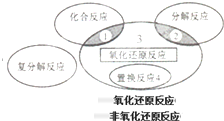

| A、4Fe(OH)2+O2+2H2O=4Fe(OH)3 | ||||
B、2NaHCO3
| ||||
C、4NH3+5O2
| ||||
| D、Zn+H2SO=ZnSO4+H2↑ |
下列离子方程式中,正确的是( )
| A、Ca(OH)2浊液与稀盐酸反应:Ca(OH)2+2H+=Ca2++2H2O |
| B、稀硫酸滴在铁片上:2Fe+6H+=2Fe3++3H2↑ |
| C、铜片插入硝酸银溶液中:Cu+Ag+=Cu2++Ag |
| D、大理石溶于醋酸的反应:CaCO3+2H+=Ca2++CO2↑+H2O |