题目内容
6.A、B、C、D四种短周期元素,A元素的一种同素异形体是自然界硬度最大的单质,C与A同主族,C元素的原子序数是B的2倍,工业上以D元素的单质与石灰乳为原料制造漂白粉.按要求回答下列问题:(1)B的原子结构示意图为
 ;镁条在气体B中燃烧生成的物质是Mg3N2(填化学式);
;镁条在气体B中燃烧生成的物质是Mg3N2(填化学式);(2)A的非金属性强于C,请用一个化学反应方程式表示2CO2+Na2SiO3+2H2O=H2SiO3↓+2NaHCO3或CO2+Na2SiO3+H2O=H2SiO3↓+Na2CO3;
(3)写出元素D的单质与石灰乳制漂白粉的化学方程式2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O.
分析 A、B、C、D四种短周期元素,A元素的一种同素异形体是自然界硬度最大的单质,则A为碳元素;C与A同主族,则C为Si;C元素的原子序数是B的2倍,则B为N元素;工业上以D元素的单质与石灰乳为原料制造漂白粉,则D为Cl,据此解答.
解答 解:A、B、C、D四种短周期元素,A元素的一种同素异形体是自然界硬度最大的单质,则A为碳元素;C与A同主族,则C为Si;C元素的原子序数是B的2倍,则B为N元素;工业上以D元素的单质与石灰乳为原料制造漂白粉,则D为Cl.
(1)B为N元素,原子结构示意图为 ,镁条在气体B中燃烧生成的物质是:Mg3N2,
,镁条在气体B中燃烧生成的物质是:Mg3N2,
故答案为: ;Mg3N2;
;Mg3N2;
(2)碳的非金属性强于Si,可以利用最高价含氧酸的酸性强弱比较,相应方程式为:2CO2+Na2SiO3+2H2O=H2SiO3↓+2NaHCO3或CO2+Na2SiO3+H2O=H2SiO3↓+Na2CO3,
故答案为:2CO2+Na2SiO3+2H2O=H2SiO3↓+2NaHCO3或CO2+Na2SiO3+H2O=H2SiO3↓+Na2CO3;
(3)元素D的单质与石灰乳制漂白粉的化学方程式为:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O,
故答案为:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O.
点评 本题考查结构性质位置关系应用,侧重考查学生对基础知识的掌握与迁移运用能力,难度中等.

练习册系列答案
 优学名师名题系列答案
优学名师名题系列答案
相关题目
16.下列反应的离子方程式书写正确的是( )
| A. | 用氨水吸收少量SO2气体:NH3•H2O+SO2→NH4++HSO3- | |
| B. | FeI2溶液中通入Cl2至Fe2+恰好完全被氧化:2Fe2++Cl2→2Fe3++2Cl- | |
| C. | 碳酸氢铵溶液中加入过量氢氧化钠溶液:HCO3-+OH-→CO32-+H2O | |
| D. | 在Ca(ClO)2溶液中通入足量的CO2气体:ClO-+CO2+H2O→HClO+HCO3- |
14.A gSO2与B gSO3所含氧原子个数相等,则A与B的比值为( )
| A. | 1:1 | B. | 2:3 | C. | 3:2 | D. | 6:5 |
11.常温下,下列各组离子一定可以大量共存的是( )
| A. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=10-4的溶液中:Na+、SiO32-、SO32-、K+ | |
| B. | 加入Al能放出H2的溶液中:Cl-、Mg2+、NO3-、K+ | |
| C. | 由水电离出的c(OH-)=10-13mol•L-1的溶液中:ClO-、Na+、SO32-、Cl- | |
| D. | pH=1的溶液中:Mg2+、Br-、K+、AlO2- |
15.某化学反应的能量变化如图所示.下列有关叙述正确的是( )
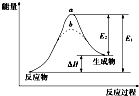

| A. | 逆反应的活化能小于正反应的活化能 | |
| B. | a、b分别对应有催化剂和无催化剂的能量变化 | |
| C. | 该反应的反应热△H=E2-E1 | |
| D. | 催化剂能改变反应的焓变 |
16.相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:A (g)+3B (g)?2C (g)△H=-50kJ/mol
实验测得起始、平衡时的有关数据如下表:
下列叙述正确的是( )
实验测得起始、平衡时的有关数据如下表:
| 容器编号 | 起始时各物质物质的量/mol | 平衡时反应中的能量变化 | ||
| A | B | C | ||
| (1) | 1 | 3 | 0 | 放出热量a kJ |
| (2) | 0 | 0 | 2 | 吸收热量b kJ |
| (3) | 2 | 6 | 0 | 放出热量c kJ |
| A. | A的体积分数:(2)>(1)>(3) | |
| B. | 三个容器内反应的平衡常数:K(3)=K2(1)=K2(2) | |
| C. | 达平衡时体系压强:P(3)=2P(1) | |
| D. | 热量关系:a+b=50 |
