题目内容
6.己知亚硫酸为二元中强酸,不稳定,易被氧化请回答下列问题:(1)下列有关亚硫酸的性质的判断正确的是abcd.
a.具有酸性 b.具有氧化性 c.具有还原性 d.有刺激性气味
(2)亚硫酸在水中电离的方程式为H2SO3?H++HSO3-,HSO3-?H++SO32-.(填标号).
(3)将亚硫酸钠溶液滴入到几种不同溶液中的现象如下表所示:
| 实验序号 | 试剂 | 现象 |
| I | 饱和Ag2SO4溶液 | 产生白色沉淀 |
| II | 0.2mol•L-1CuCl2溶液 | 溶液变绿,继续滴加产生棕黄色沉淀 |
| III | 0.1mol•L-1Al2(SO4)3溶液 | 开始无明显变化,继续滴加产生白色沉淀 |
②经检验,实验II中的棕黄色沉淀中不含SO42-,含有Cu+、Cu2+和SO32-.推测反应后的溶液中一定含有溶质电离出的阴离子是SO42-、Cl-,请选用合适的试剂分别验证这些离子:取少量滤液,用足量盐酸酸化后滴加氯化钡溶液,有白色沉淀生成,证明含SO42-;另取少量滤液,用足量硝酸酸化后滴加硝酸钡溶液,过滤,向所得滤液中滴加硝酸银溶液,有白色沉淀生成,证明含Cl-.
③已知:Al2(SO3)3在水溶液中不存在,经检验,实验III中的白色沉淀中无SO42-,该白色沉淀既能溶于强酸,又能溶于强碱,还可使酸性KMnO4溶液褪色.推测沉淀中含有的阴离子为SO32-、OH-.
分析 (1)亚硫酸为二元酸,具有还原性,可分解生成具有刺激性气味的二氧化硫;
(2)亚硫酸为二元弱酸,以第一步电离为主;
(3)①实验I中的白色沉淀是Ag2SO3.可说明Ag2SO3溶解度较小;
②实验II中的棕黄色沉淀中不含SO42-,含有Cu+、Cu2+和SO32-.说明铜离子和亚硫酸根离子发生氧化还原反应生成SO42-,溶液中含有氯离子;
③实验III中的白色沉淀中无SO42-,该白色沉淀既能溶于强酸,又能溶于强碱,说明含有氢氧化铝,还可使酸性KMnO4溶液褪色,说明含有还原性的SO32-.
解答 解:(1)亚硫酸为二元酸,具有还原性,可分解生成具有刺激性气味的二氧化硫,S为+4价,亚硫酸也具有氧化性,故答案为:abcd;
(2)亚硫酸为二元弱酸,以第一步电离为主,电离方程式为H2SO3?H++HSO3-,HSO3-?H++SO32-,故答案为:H2SO3?H++HSO3-,HSO3-?H++SO32-;
(3)①实验I中的白色沉淀是Ag2SO3.可说明Ag2SO3溶解度较小,反应的离子方程式为2Ag++SO32-=Ag2SO3↓,故答案为:2Ag++SO32-=Ag2SO3↓;
②实验II中的棕黄色沉淀中不含SO42-,含有Cu+、Cu2+和SO32-.说明铜离子和亚硫酸根离子发生氧化还原反应生成SO42-,溶液中含有氯离子,检验方法为取少量滤液,用足量盐酸酸化后滴加氯化钡溶液,有白色沉淀生成,证明含SO42-;另取少量滤液,用足量硝酸酸化后滴加硝酸钡溶液,过滤,向所得滤液中滴加硝酸银溶液,有白色沉淀生成,证明含Cl-,
故答案为:SO42-、Cl-;取少量滤液,用足量盐酸酸化后滴加氯化钡溶液,有白色沉淀生成,证明含SO42-;另取少量滤液,用足量硝酸酸化后滴加硝酸钡溶液,过滤,向所得滤液中滴加硝酸银溶液,有白色沉淀生成,证明含Cl-;
③实验III中的白色沉淀中无SO42-,该白色沉淀既能溶于强酸,又能溶于强碱,说明含有氢氧化铝,还可使酸性KMnO4溶液褪色,说明含有还原性的SO32-,
故答案为:SO32-、OH-.
点评 本题考查性质实验的设计,为高考常见题型,题目难度较大,试题涉及物质组成、性质、离子方程式、离子的检验方法等知识,试题知识点较多,综合性较强,充分考查了学生灵活应用基础知识的能力.

| A. | 氨水跟盐酸反应:OH-+H+→H2O | |
| B. | 铁与硝酸银溶液反应:Fe+Ag+→Fe2++Ag | |
| C. | 氢氧化铜与稀硫酸反应:Cu(OH)2+2H+→Cu2++2H2O | |
| D. | 氢氧化钡跟稀硫酸反应:Ba2++OH-+H++SO42-→BaSO4↓+H2O |
Ⅰ.请你利用原电池原理,设计实验,比较铜和铁的金属活动性.
实验用品:铁片、铜片、导线、金属夹、小灯泡、硫酸亚铁溶液、硫酸铜溶液、500mL烧杯.
画出实验装置简图,并标出正负极、电子流动方向.
Ⅱ.为了研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验,请回答下列问题.
| 编号 | 操作 | 实验现象 |
| ① | 分别在试管A、B中加入3mL 5% H2O2溶液,各滴入2滴1mol/L FeCl3溶液.待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中浸泡;将试管B放入盛有40℃左右热水的烧杯中浸泡. | 试管A中不再产生气泡; 试管B中产生的气泡量增大. |
| ② | 另取两支试管分别加入3mL 5% H2O2溶液和3mL 10% H2O2溶液 | 试管A、B中均未明显见到有气泡产生. |
(2)实验①的目的是研究温度对H2O2分解速率的影响.
实验中滴加FeCl3溶液的目的是加快H2O2分解速率,使实验现象易于观察.
(3)实验②未观察到预期的实验现象,为了帮助该同学达到实验目的,你提出的对上述操作的改进意见是将两支试管同时放入盛有相同温度热水的烧杯中,或向两支试管中同时滴入2滴1mol/LFeCl3溶液,观察产生气泡的速率(用实验中所提供的几种试剂).
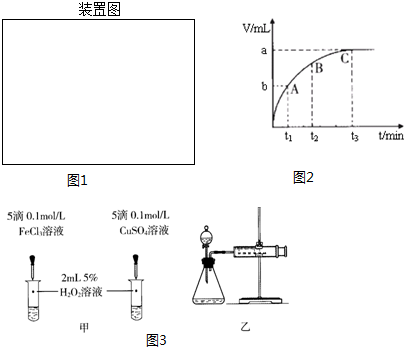
(4)某同学在50mL一定浓度的H2O2溶液中加入一定量的二氧化锰,放出气体的体积(标准状况下)与反应时间的关系如图2所示,则A、B、C三点所表示的瞬时反应速率最慢的是C.
(5)对于H2O2分解反应,Cu2+也有一定的催化作用.为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图3甲、乙所示的实验.请回答相关问题:
①定性分析:如图甲可通过观察溶液中气泡产生的速率,定性比较得出结论.有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是排除氯离子的干扰.
②定量分析:用图3乙所示装置做对照实验,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略.实验中需要测量的数据是收集40mL气体所需的时间.
| A. | 在常温、常压下,11.2升N2含有的分子数为0.5 NA | |
| B. | 标准状况下,22.4LH2和O2的混合气体所含的分子数为NA | |
| C. | 标准状况下,18g H2O的体积是22.4L | |
| D. | 1mol任何物质的体积在标准状况下都约是22.4L |
下列说法正确的是( )
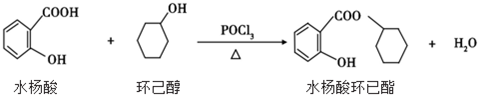
| A. | 水杨酸的核磁共振氢谱有 4 个吸收峰 | |
| B. | 水杨酸、环已醇和水杨酸环已酯都能与 FeCl3 溶液发生显色反应 | |
| C. | 1mol 水杨酸跟浓溴水反应时,最多消耗 2molBr2 | |
| D. | 1mol 水杨酸环已酯在 NaOH 溶液中水解时,最多消耗 3molNaOH |
| A. | 碳酸钠固体 | B. | 少量锌粉 | C. | 硫酸钾溶液 | D. | 盐酸溶液 |